ヒドロキシル基の求核置換
ハロゲン化アルキルの化学的挙動は、アルコールの類似置換および脱離反応を発見する際の参考として使用することができる。 主な違いは、もちろん、脱離アニオンのハロゲン化物から水酸化物への変化である。 酸素は塩素よりもわずかに電気陰性であるため(ポーリングスケールでは3.5対2.8)、C-O結合はC-Cl結合よりも極性が高いと予想される。, さらに、NMR化学シフト(13Cとαプロトンの両方)から炭素原子の求電子特性の独立した尺度は、sp3ハイブリダイズ炭素原子に結合したときに酸素と塩 この有望な背景証拠にもかかわらず、アルコールは一般的にハロゲン化アルキルで観察される同じSN2反応を受けない。 例えば、1-ブロモブタンとシアン化ナトリウムとの急速なSN2反応は、1-ブタノールをシアン化ナトリウムで処理すると平行ではない。, 実際には、このようなハロゲン化アルキル置換反応の溶媒としてエチルアルコールがしばしば用いられる。
CH3CH2CH2CH2–Br+Na(+)CN(–) CH3CH2CH2CH2–CN+Na(+)Br(–)
CH3CH2CH2CH2–CN+Na(+)Br(–)
CH3CH2CH2CH2–OH+Na(+)CN(–) 反応なし
反応なし
ここで重要な要因は、脱離アニオン(臭化物と水酸化物)の安定性です。, HBrは水よりもはるかに強い酸(18桁以上)であり、この違いはそれぞれの共役塩基を生成する反応に反映されています。 より弱い塩基、臭化物はより安定であり、置換または脱離反応におけるその放出は、より強く安定でない塩基である水酸化物イオンのそれよりもはるかに有利である。
SN2反応におけるアルコールの反応性を改善するための明確なステップは、脱離アニオンとしての安定性を改善する方法で–OH官能基, そのような修飾の一つは、強酸中で置換反応を行い、–OHを–OH2(+)に変換することである。 ヒドロニウムイオン(H3O(+))は水よりもはるかに強い酸であるため、その共役塩基(H2O)は水酸化物イオンよりも優れた脱離基である。 この戦略の唯一の問題は、シアン化物を含む多くの求核剤が強酸中のプロトン化によって失活し、置換に必要な求核共反応物を効果的に除去することである。, 強酸Hcl、HbrおよびHIは、それらの共役塩基が良好な求核剤であり、アルコールよりも弱い塩基であるため、この困難の対象とならない。こんにちは、hiは、 以下の式は、これらの酸の影響を受ける可能性のあるアルコールのいくつかの置換反応を示す。 ハロゲン化アルキルと同様に、1π-アルコールの求核置換はSN2機構によって進行するのに対し、3π-アルコールはSN1機構によって反応する。 2π-アルコールの反応は両方の機構によって起こり、しばしばいくつかの再配列生成物を生成する。, 鉱酸式の横にある括弧内の数字は、濃縮水溶液の重量パーセントを表し、これらの酸が通常使用される形態である。
これらの反応は”酸触媒”と呼ばれることがありますが、これは厳密には正しくありません。 全体的な変換では、強いHX酸は非常に弱い酸である水に変換されるため、アルコールをハロゲン化アルキルに完全に変換するには少なくとも化学量論, この反応において同等の量の非常に強い酸を使用する必要性は、上記に示されたタイプの単純なアルコールに対するその有用性を制限する。 酸感受性基を有するアルコールは、もちろん、そのような治療に耐えられない。 しかし、その考えの変更-OH機能グループ改善のため安定していくアニオンを追跡することができる。 次の図は、効果が証明されたいくつかの変更を示しています。 それぞれの場合において、ヒドロキシル基は強酸のエステルに変換される。 最初の二つの例は、前述のスルホン酸エステルを示しています。, 第三および第四の例は、それぞれ亜リン酸エステル(Xは残りの臭素類または追加のアルコール置換基を表す)および亜クロロ亜硫酸エステルの形成を示 これらの脱離基(青色の)はすべて、水よりもはるかに強い共役酸を有する(13-16乗);したがって、脱離アニオンはそれに応じて水酸化物イオンよりも安定である。 メシレートおよびトシレート化合物は、多種多様な求核剤との置換反応に使用できるので、特に有用である。, アルコールと三臭化りんおよび塩化チオニルとの反応で生成する中間体はほとんど単離されず,これらの反応は臭化アルキルおよび塩化物生成物を生成し続ける。
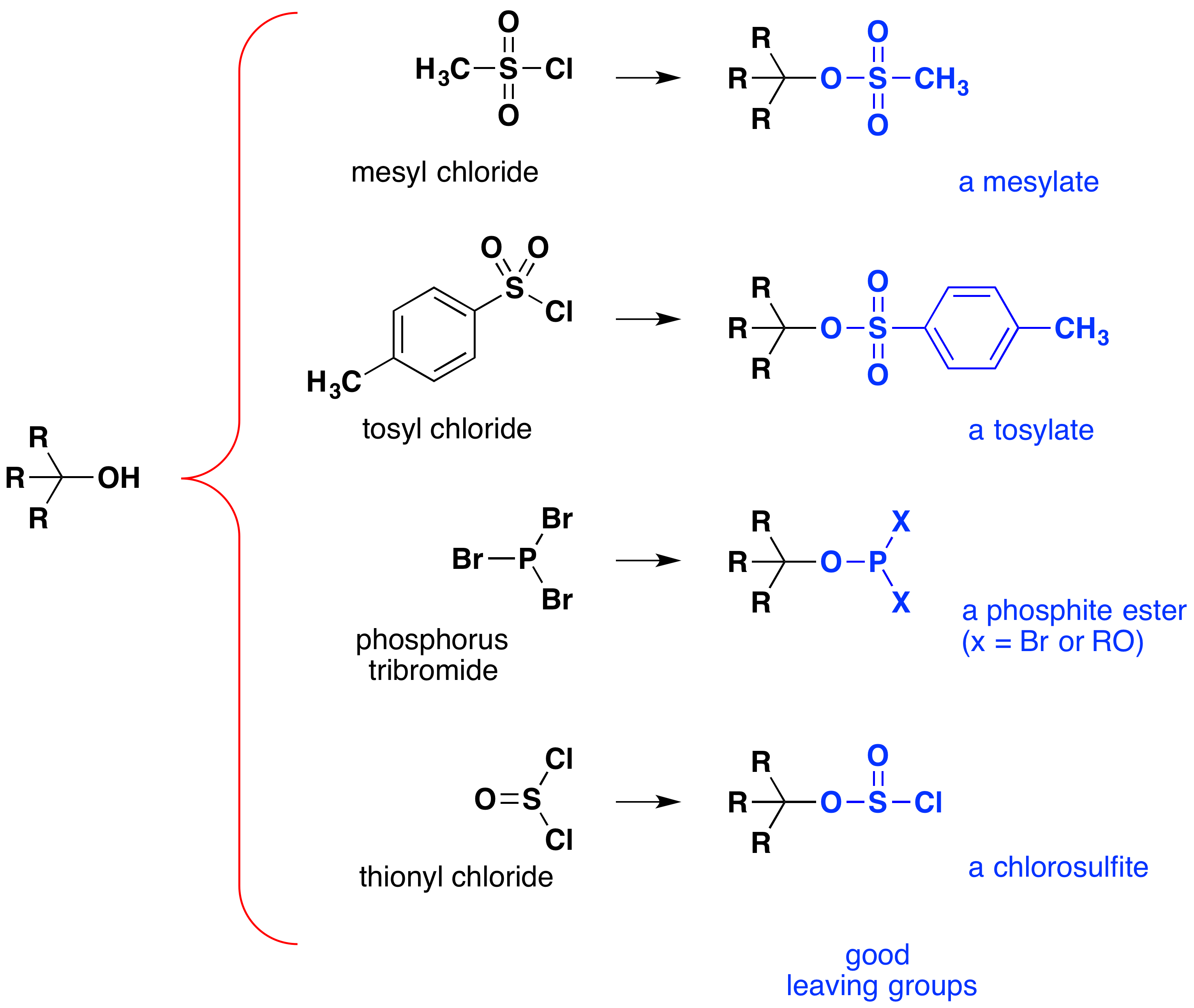
アルコールの一般的な求核置換反応におけるスルホン酸エステル中間体の重要性は、1-ブタノールをペンタネニトリル(ブチルシアン化)に変換することによって示される。, 一方,りんおよびチオニルハロゲン化物は,アルコールを対応するアルキルハロゲン化物に変換するだけである。,
| CH3CH2CH2CH2–OH + CH3SO2Cl | pyridine |
CH3CH2CH2CH2–OSO2CH3 | Na(+) CN(–) |
CH3CH2CH2CH2–CN + CH3SO2O(–) Na(+) |
Some examples of alcohol substitution reactions using this approach to activating the hydroxyl group are shown in the following diagram., 最初の二つのケースは、アルコールのスルホン酸エステル誘導体が様々なSN2反応においてアルキルハロゲン化物を置き換えることができるという事実 次の二つのケースは、臭化物にアルコールを変換する際に三臭化りんの使用を示しています。 この試薬は、亜リン酸生成物がHBrよりも弱い酸であるため、塩基(例えばピリジン)を添加しないで使用することができる。 三臭化リンは1π-アルコールと最もよく使用されます2π-アルコールは頻繁に競争SN1反作用に起因する転位の副産物をもたらすので。, 濃縮HBrを用いた代替合成はエーテルを切断するのに対し、反応4のエーテル酸素はこの試薬の影響を受けないことに注意してください。 三塩化リン(PCl3)は同様にアルコールを塩化アルキルに変換するが、無機生成物はガスであるため、塩化チオニルが通常この変換に好ましい(SO2&HCl)。 三ヨウ化リンは安定ではないが、赤リンとヨウ素の混合物からその場で生成され、アルコールをヨウ化アルキルに変換するように作用する。, 最後の例は、塩化チオニルとキラルな2π-アルコールとの反応を示している。 ピリジンのような有機塩基の存在は、クロロスファイト中間体の最終的なSN2反応に必要な塩化物イオンのかなりの濃度を提供するので重要である。, 塩基が存在しない場合、クロロスファイトは加熱すると分解して構成を保持して期待される塩化アルキルを得る
三級アルコールはSN1とE1反応経路が支配的で制御が困難であるため、ここで説明するタイプの置換反応には一般的に使用されていない。

多くの置換反応における中間体としてのスルホン酸エステルの重要性を誇張することはできません。, SN2反応における置換部位で起こる配置反転の厳密な証明は、このような反応を利用する。 そのような証明の例を以下に示します。 より一般的に使用されるスルホニル誘導体の略号を以下の表に示す。
| スルホニル基 | CH3SO2– | CH3C6H4SO2– | brc6h4so2– | cf3so2– |
|---|---|---|---|---|
| 名前&略語。, | メシルまたはMs | トシルまたはTs | ブロシルまたはBs | トリフィルまたはTf |
反転証明

ヒドロキシル置換反応のより完全な議論およびこの変換のための他の選択的方法の説明については、ここをクリックしてください。
貢献者
- ウィリアム-ロイシュ名誉教授(ミシガン州U.,), Virtual Textbook of Organic Chemistry