Introduction
冬の間、皮膚科医は無症候性の患者を受け取り、おそらく炎症後の変色以外の特定の病変はないが、助けが絶望的に必要である。 彼らは、今年の最初の強烈な太陽への暴露の後に皮膚に現れる多数の丘疹または小胞の話を始めます。, 病変と一緒に、ひどいかゆみが始まり、次の太陽への暴露に続いて病気の広がりとともに増加し、時には一種の灼熱感によって悪化する。 それにもかかわらず、この人々はモデル太陽のシーカーであり、丘疹が次第に衰退し、消えるのを待っている夏中の日光を楽しみ続ける。 主な質問は:これを防ぐにはどうすればよいですか? なぜ私は今”5″年以来この問題を抱えていますが、私は以前にそれを持っていませんでしたか?,
私たちは、おそらく多形性光噴火(PLE)を扱っており、私たちの患者の要求に従って、医学研究は、主に予防戦略に焦点を当ててきました今日では非常に 他の側では、複数のピースがこのかなり複雑なパズルに追加されていない限り、第二と確かにあまり探求の質問は、不明のままです。 この簡単なレビューの目的は、PLE可能なメカニズムと予防または治療のための最も使用されるプロトコルの最新の進歩を再開することです。
多形性光噴火の病態学:新着情報?,
PLEは、患者の皮膚の紫外線(UVR)曝露から数時間以内に発症する非scar痕性pr痒性紅斑性丘疹、小胞またはプラーク(図1)の間欠的な噴火を特徴とする最も一般的な感光性障害である。 この疾患は、遺伝的感受性、ならびに曝露のタイプなどの環境成分に依存する。 Pleは家族で集まるようである:pleの有病率が一卵性双生児および二卵性双生児の21そして18%、それぞれだったことが推定された(1)。, また、最初の程度の親戚におけるPLEの正の家族歴は、影響を受けたツインペアの12%に関して影響を受けていないツインペアの4%に存在していた(p<0.0001)。 一卵性における発端コンコーダンスは、強い遺伝的効果を示す、二卵性双生児のペア(それぞれ0.72対0.30)よりも優れていた(1)。 PLEの病因における潜在的な関心のある多くの遺伝子は、一般的に報われない結果で調査されている。, 分離分析を用いて、英国の人口の72%が低浸透度PLE感受性対立遺伝子を運ぶことが推定されている(2)。
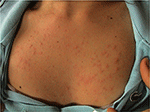
図1. 若い女性における多形性光噴火の臨床像。
アポトーシスの失敗:可能な光誘発性Neo抗原
最近のゲノムワイド発現解析では、唯一の16遺伝子が差コントロール(3)に関して紫外線照射後のPLEと健康なコントロール, これらの遺伝子のうち、14はple患者で低発現を示したが、二つは過剰発現をもたらした。 PLEの発現が低い14遺伝子の中には、補体1sサブユニット(C1s)、スカベンジャー受容体B1(SCARB1)フィブロネクチン(FN1)、免疫グロブリンスーパーファミリーメンバー3(IGSF3)、カスパーゼ1(CASP1)およびパラオキソナーゼ2(PON2)、アポトーシス細胞クリアランスに関連するすべての遺伝子がある。 アポトーシス細胞クリアランス中のタンパク質修飾は、潜在的な自己抗原形成につながる可能性があると考えられている(4)。, そして、このプロセスに接続された遺伝子のple患者における発現の低下は、可能な自己抗原源だけでなく、疾患を促進する自己免疫過程の開始における重要な段階を表すかもしれない(3)。 これらの知見に従って、Kuhn et al. ple患者におけるアポトーシス細胞の蓄積を示した1.5最小紅斑線量(MED)UVBの、または60-100J/cm2UVA1のコントロール(5)と比較して照射しました。,
免疫:寛容の失敗
アポトーシス細胞の非効率的なクリアランスから派生する自己抗原は、おそらく樹状細胞(Dc)によって取り込まれ、その後自己反応性T細胞(6、7)に変換されたナイーブT細胞(細胞傷害性およびヘルパー)に提示される。 アポトーシスのこの部分的な障害は、一緒にple患者の典型的な臨床症状につながる、抗原認識とプレゼンテーションに、uv暴露後の不十分な免疫抑制と、貢献しています(8)。, 実際,正常UVR誘発性免疫抑制の障害はPLEにおける主な免疫学的異常として証明されており,最初は表皮におけるLangerhans細胞(Lcs)の永続性によって説明されている。 機能的紫外線誘発耐性に逃れる免疫系のこの過剰活性化は、おそらくPLE患者における皮膚癌の有病率の低下の原因である(9)。 一方、同じメカニズムは、UVR暴露後のアレルギー性接触皮膚炎(ACD)抑制の失敗のために有罪である(10)。,
炎症経路:遅延型過敏症反応
pleに関与する免疫学的機構は、先天性免疫系および適応免疫系からのメディエーターを有し、組織学的または生化学的観点から、ACDのものと非常に類似している。 実際には、初期の七十人では、エプスタインは、最初の未定義のUVR誘発皮膚抗原(に遅延型過敏反応(DTHR)としてPLEを示した11)。 最近、この概念を強化するために、ACDに関与する炎症性メディエーターのいくつかがPLEにおいても実証されている。, 例えば、IL-1ファミリー(12、13)、免疫調節および炎症(14)においていくつかの役割を果たしているサイトカインの成長グループは、ACDの病因(12、15)にも関与し、PLE(16)でも IL-36αとIL-36β、IL-1ファミリーのプロ炎症性メンバーは、ACDサンプルとして、コントロールに関してpleで増加したが、IL-36βははるかにACD(16)よりもPLEで強化され IL-36RおよびIL-1R/AcP(IL-1RL2)、IL-36α、IL-36βおよびIL-36βからなる共通受容体を介して作用することは、NF-κbおよびMapkを活性化し、炎症反応を促進する。, PLE患者の皮膚および末梢血におけるIL-36sの増加は、複数の炎症性皮膚状態(に見られるように、局所および全身性免疫応答の活性化を示す15、17、18)。 おそらく、IL-36sとUVR暴露との間のリンクは、壊死性ケラチノサイトによるRNAの放出によるtoll様受容体(TLR)-3活性化のパラクリン炎症性シグナルによって表される19)。 確かに、pleにおけるアポトーシスクリアランスの失敗は、細胞破片の豊富さと、この”警告信号の増幅の原因となる可能性があります。,”
また、IL-36sは、自然免疫シグナルとその結果としての炎症性カスケードを増幅するために貢献することができ、抗菌ペプチド(AMPs)を促進する(20)。
炎症経路:AMPsとマイクロバイオーム
主に複数の皮膚炎症プロセスで検討されているように、ディフェンシン(αとβ)、カテリシジン(LL37)、リボヌクレアーゼ7(RNase7)とソリアシン(S100A7)として命名されたこれらのメディエーターは、ケラチノサイトと皮膚マイクロバイオーム上のUVRによって誘導される不均衡に照らして、PLE(21、22)でも検討されている。 Patra et al., ソリアシン、RNase7、HBD-2、およびLL-37の発現は、HBD-3が減少したのに対し、PLE病変皮膚で増加したことを見出した。 皮膚表面を”多民族の世界”と考えると、ケラチノサイトの重要な役割を忘れることなく、AMPs放出がUV相互作用の後のマイクロバイオーム成分の修飾によって決定されることを排除することはできません(23)。 確かに、マイクロバイオームは、ケラチノサイト損傷につながる、PLE患者で形成されたまだ検出されていないUVR誘発抗原の直接的または間接的なソースを表すことができます。, 結果として、LL-37は、UVB、IFNy、TNF-α、IL-6によっても誘導され、PLE(23)の潜在的な間接的なドライバーを表すことができる。 これは、pdcを活性化することができる自己核酸と凝集体を形成することができます:乾癬では、主な自己抗原(として認識されています24)。 PLE患者では、pdcの完全な欠如が報告されているにもかかわらず(25)、自己免疫環境が存在し、LL-37は、他の炎症経路を誘導する、極めて重要な役割を果たすことができます。 図S1(補足資料)では、上記で表現された概念を漫画で視覚化しています。
多形性光噴火の治療:新しいものは何ですか?,
PLEの治療の最初の行には、日焼け止め、日焼け止めおよび局所コルチコステロイド(26)が含まれる。 すべての患者のために予防管理は年の最初の露出の間に強いUVRの露出の回避および防護衣の使用、また日焼け止めの適用によって、特に晴れた日 Uvb(SPF)のための高い太陽保護係数を有する新世代の広域スペクトル日焼け止めは、一緒に長波長のUVA保護と、ple患者(の90%までの合計または部分的な保護を与えることが報告されている27、28)。, 経口抗酸化物質およびニコチンアミドの使用は、これらの患者のための追加の有効な予防措置を表すことができる。 ニコチンアミドの有益な効果は、42人の患者の制御されていない試験で調査されており、そのうちの60%が、日光暴露前に毎日2-3gのニコチンアミドを服用したときの症状の完全な廃止を報告した(29)。 さらに、熱帯シダのPolypodiumleucotomos[PL)のエキスは有効な酸化防止効果および免疫調節効果を出すために示されていました。, 太陽暴露前に480mg/毎日で投与すると、皮膚反応および自覚症状を有意に減少させた(30、31)。 局所コルチコステロイドに関しては、PLEにおけるそれらの有効性を決定するための試験がなされていない場合でも、かゆみを軽減するために広く PLEのための治療の第二の行は、全身性コルチコステロイドおよび写真(化学療法)療法(が含まれています26)。 ランダム化、二重盲検、プラセボ対照試験(32)で著者らは、噴火の発症時に25mgのプレドニゾロンを毎日4-5日間使用することを提案した。, 、Prednisoloneの繰り返されたコースの潜在的な長期副作用が考慮されなければならないがpleの臨時の攻撃に苦しむあらゆるcontraindicationsがない患者のために助言でき Pleの穏やかなケースでは、春の日光への大学院の露出による自己調節プログラムは十分かもしれない(33)。 一方、より重度の症例では、医学的に監督されたコンディショニング/脱感作治療がより適切であり得る。, ソラレンおよびUVA療法(PUVA)、狭帯域(NB)-UVBまたは広帯域(BB)-UVB光線療法のコースは、通常、春先に投与され、予防的治療(効果的なだけでなく、することができます26)。 治療プロトコルは、コphototherapy/photochemotherapy5-6以上週間です。 開始用量は、最小紅斑線量(MED)または最小光毒性線量(MPD)に依存し、多くの場合、これらの測定された閾値の50-70%であり、増分増加を伴う。, 脱感作療法で得られた利益を維持するために、夏を通して定期的な日光暴露が推奨され、さもなければ硬化は4-6週間以内に失われる可能性がある。 PLEの治療において、NB-UVBは、光発癌のリスクが低く、mopの摂取に伴う悪心または他の副作用のリスクがなく、治療後の眼保護を使用する必要がないため、PUVA(勧告の強さD;証拠のレベル4)よりも優先されるべきである。 しかし、NB-UVBが失敗した場合、または以前に噴火を引き起こした場合は、他の全身治療の前にPUVAを考慮する必要があります。, 実際には、以下に記載されているように、複数の光線療法レジメン(BB-UVB、NB-UVBおよびPUVA)に対して有効性が証明されており、副作用は、発疹の誘発の観点から、紅斑およびかゆみがPUVA(34)よりもUVBでより一般的であることが判明した。 要約されるように、文献において、PUVAの有効性は65-100%の光保護率をもたらす(34)。, 複数の比較研究が行われているが、PUVAとNB-UVBプラスプラセボ錠の間の唯一の無作為化比較試験から、週に5週間三回、pleまたは野外活動制限の発生を考慮して、有効性に有意差は現れなかった(35)。 Manらによって報告された10年間の遡及的なレビューで。 (36)、中等度から重度のPLEを有する170人の患者は、PUVAおよび/またはUVB光線療法を受けた。 詳細には、8人の患者がPUVAを受け、128NB-UVB、5BB-UVB、およびNB-UVBに満足に応答することができなかった29人の患者は、翌年PUVAを与えられた。, 重症度の自己評価を行い,秋または次の春のフォローアップ訪問でPLEエピソードの頻度を報告した。 PUVAで治療された患者の88%およびUVBを受けた89%で良好または中等度の改善が報告された。 PUVAおよびNB-UVBの両方で治療された患者のうち、大多数はPUVAを好んだ。 光線療法で治療された別の14年間のレトロスペクティブ研究79患者(37)では、完全/部分寛解を伴う光保護の期間で次の夏の間に測定された有効性は、PUVAで65%、BB-UVBで82%、UVA単独で83%であった。, この場合、PUVAによる治療は、より重度のPLE形態に予約されていた。
光線療法が光保護を誘導するメカニズムは完全には理解されていない。
しかし、ここ数年で多くの進歩が行われています。 光線療法のメラニン化および表皮肥厚に対するよく知られた効果に加えて、UV誘導免疫調節および抗炎症特性の広い範囲が報告されている(38)。, UVBとUVAの両方が接着分子の発現を調節し、aメラノサイト刺激ホルモン、IL-10(インターフェロンγの産生を抑制する)、プロスタグランジンE2などの可溶性メディエーターを誘導し、t細胞の活性化を防止し、皮膚浸潤T細胞のアポトーシスを促進する(34)。 さらに、ple患者における予防的紫外線光硬化は、uv-免疫抑制における重要な細胞イベントの一つである表皮から皮膚排出リンパ節へのUV誘発性LC移行を回復させることが実証されている(39)。, LCによって誘導される耐性は、IL-10などの免疫抑制性サイトカインの放出、および調節T細胞(Treg)の成熟および誘導への干渉によって媒介される(40)。 さらに、最近、LC、TregsおよびビタミンD3の間で興味深いリンクが報告されている。 確かに、短期1週間の局所前治療1,25-ジヒドロキシビタミンDアナログ、カルシポトリオールは、その後の実験光プロボケーション(41)の後にPLE症状を減少させたことが実証されている。, さらに、マウスの研究では、1,25-ジヒドロキシビタミンDは、UV(と同等の免疫抑制効果を示した42)。 LCsと肥満細胞の間でもう一つの興味深いクロストークが強調されている。 アトピーにおけるそれらの認識された役割に加えて、皮膚肥満細胞はまた、UVB誘発炎症から皮膚を保護するための責任があり、UV免疫抑制を促進する(40)。 ヒトの研究では、急性および慢性UVR暴露後、IL-10の放出とともに皮膚肥満細胞数が増加することが実証されている。, 全体的にこれらのデータは、PLEにおける肥満細胞のための潜在的な役割を示唆し、光硬化のメカニズムにおいて。 これに従って、Wolf et al. 光硬化がple患者の真皮乳頭における肥満細胞密度を有意に増加させることが初めて報告されている(40)。 要約すると、光硬化は、複数の細胞タイプを含む正常なUV免疫抑制経路を回復させることによって、PLEにおいて機能する。 PLEのための第三の行の治療には、アザチオプリンおよびシクロスポリンなどの全身性免疫抑制薬の使用が含まれる。, しかし、正常に治療された患者の散発的な症例のみが文献で報告されている(43、44)。 さらに、ヒドロキシクロロキン、オメガ3脂肪酸、およびβ-カロチンが治療法として提案されているが、それらの臨床的有効性を実際に評価するためのさらなる二重盲検、無作為化比較試験が必要である。
結論
不快感やライフスタイルの制限に関連するPLEの高い有病率と発生率の増加以来、将来の研究は、新しい治療および/または予防戦略を見, 適切なPLE治療の選択は、フォトテストを行う可能性とともに、疾患の個々の臨床経過に関する十分な知識を必要とする。 炎症プロセスの可能な活性化および促進におけるいくつかの新しい側面が強調されている。,
知識の現在の状態には、免疫寛容の回復に関与するいくつかの重要な細胞調節の同定にもかかわらず、適切な研究の欠如とアウトカム尺度を評価することの難しさのために、PLEにおける様々な潜在的な治療法の有効性について明確な結論を引き出すことは困難である。 PLE重症度(PLESI)(45)を評価するための臨床スコアは、ほとんど使用されず、主に研究目的に限定された器具のままである。, 障害の根底にある病原性メカニズムのより深い研究は、よりターゲットを絞った治療アプローチを可能にします。
著者寄稿
SL原稿を投影し、論文の材料を選択し、最初の草案を書いて、原稿の以下の草案を修正しました。 ARは原稿の執筆に従事し、内容とスタイルの新しいアイデアをサポートしました。,
利益相反声明
著者らは、この研究が潜在的な利益相反と解釈され得る商業的または財務的関係がない場合に行われたと宣言している。
補足資料
図S1. 表皮におけるアポトーシス障害の文脈における先天性免疫系と適応免疫系の間の相互作用。 (緑の記号)Psoriasin:PLEの皮の棘状および粒状の層の豊富な表現。 (青い記号)RNase7:主に顆粒層およびPLE病変の角質層のケラチノサイトに発現する。, (黄色のシンボル)LL-37は、pleの血管や腺の周りに深く発現していました。 (紫細胞記号)非効率的なクリアランスを有するアポトーシスケラチノサイト。,hic light eruption; ACD, Allergic contact dermatitis; DTHR, Delayed type hypersensitivity reaction; UVR, Ultraviolet radiation; C1s, Complement 1s subunit; SCARB1, Scavenger receptor B1; FN1, Fibronectin; IGSF3, Immunoglobulin superfamily member 3; CASP1, Caspase-1; PON2, Paraoxonase 2; MED, Minimal Erythema Dose; DCs, Dendritic cells; LCs, Langerhans cells; TLR, Toll like receptor; AMPs, Antimicrobial peptides; SPF, Sun protection factor; PUVA, Psoralen and UVA therapy; NB-UVB, Narrowband; BB-UVB, Broadband UVB; MPD, Minimum phototoxic dose; Tregs, Regulatory T cells; PL, Polypodiumleucotomos.,
2. McGregor JM, Grabczynska S, Vaughan R, Hawk JL, Lewis CM. Genetic modelling of abnormal photosensitivity in families with polymorphic light eruption and actinic prurigo. J Invest Dermatol. (2000) 115:471–6. doi: 10.1046/j.1523-1747.2000.00080.x
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Lembo S, Hawk JLM, Murphy GM, Kaneko K, Young AR, McGregor JM, et al., Aberrant gene expression with deficient apoptotic keratinocyte clearance may predispose to polymorphic light eruption. Br J Dermatol. (2017) 177:1450–3. doi: 10.1111/bjd.15200
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Savill J, Fadok V. Corpse clearance defines the meaning of cell death. Nature (2000) 407:784–8. doi: 10.,1038/35037722
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Kuhn A, Herrmann M, Kleber S, Beckmann-Welle M, Fehsel K, Martin-Villalba A, et al. Accumulation of apoptotic cells in the epidermis of patients with cutaneous lupus erythematosus after ultraviolet irradiation. Arthritis Rheum. (2006) 54:939–50. doi: 10.1002/art.21658
PubMed Abstract | CrossRef Full Text | Google Scholar
6., Savill J, Dransfield I, Gregory C, Haslett C. A blast from the past: clearance of apoptotic cells regulates immune responses. Nat RevImmunol. (2002) 2:965–75. doi: 10.1038/nri957
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Albert ML, Sauter B, Bhardwaj N. Dendritic cells acquire antigen from apoptotic cells and induce class I-restricted CTLs. Nature (1998) 392:86–9. doi: 10.,1038/32183
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Koulu LM, Laihia JK, Peltoniemi HH, Jansén CT. UV-induced tolerance to a contact allergen is impaired in polymorphic light eruption. J Invest Dermatol. (2010) 130:2578–82. doi: 10.1038/jid.2010.181
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Epstein JH. Polymorphous light eruption. J Am Acad Dermatol. (1980) 3:329–43.,
PubMed Abstract | Google Scholar
12. Mattii M, Ayala F, Balato N, Filotico R, Lembo S, Schiattarella M, et al. The balance between pro- and anti-inflammatory cytokines is crucial in human allergic contact dermatitis pathogenesis: the role of IL-1 family members. Exp Dermatol. (2013) 22:813–9. doi: 10.1111/exd.12272
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Dinarello CA., 炎症性疾患の病因および治療におけるインターロイキン-1。 血(2011)117:3720-32. 土井:10.1182/血-2010-07-273417
PubMed Abstract|CrossRef Full Text|Google Scholar
16. レンボS、カイアッツォG、バラートN、モンフレコラG、パトラV、ウルフP、ら。 多形性光発疹およびIL-1家族:アレルギー性接触皮膚炎との違いはありますか? フォトケムフォトバイオールSci. (2017) 16:1471–9. 土井:10,1039/c7pp00142h
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Balato A, Schiattarella M, Lembo S, Mattii M, Prevete N, Balato N, et al. Interleukin-1 family members are enhanced in psoriasis and suppressed by vitamin D and retinoic acid. Arch Dermatol Res. (2013) 305:255–62. doi: 10.1007/s00403-013-1327-8
PubMed Abstract | CrossRef Full Text | Google Scholar
19., ボルコフスキー AW、クオIH、バーナードJJ、吉田T、ウィリアムズ氏、ハングNJ。 Toll様受容体3の活性化は、UV損傷後の正常な皮膚バリア修復に必要です。 Jインベストメント (2015) 135:569–78. 土井:10.1038/2014.354
PubMed Abstract|CrossRef Full Text|Google Scholar
20. Li N,山崎K,斎藤R,福士-高橋S,島田-大森R,浅野M,et al. Cathelicidinの抗菌ペプチッドLL37のAlarmin機能人間の表皮のkeratinocytesのIL-36βの誘導による。 ジェイ-イムノール, (2014) 193:5140–8. doi: 10.4049/jimmunol.1302574
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Patra V, Wolf P. Microbial elements as the initial triggers in the pathogenesis of polymorphic light eruption? Exp Dermatol. (2016) 25:999–1001. doi: 10.1111/exd.13162
PubMed Abstract | CrossRef Full Text | Google Scholar
22., Gläser R,Navid F,Schuller W,Jantschitsch C,Harder J,Schröder JM,et al. UV-B照射は,invitroおよびinvivoでヒトケラチノサイトにおける抗菌ペプチドの発現を誘導する。 ジェイアールクリンイムノール (2009) 123:1117–23. 土井:10.1016/j.jaci.2009.01.043
PubMed Abstract|CrossRef Full Text|Google Scholar
23. パトラV、メイヤー G、グルーバー-ワッカーナーゲルA、ホルンM、レンボS、ウルフP。, 健康な皮膚、アトピー性皮膚炎、乾癬と比較して多形性光噴火病変における抗菌ペプチド発現のユニークなプロファイル。 フォトデジタルマトールフォトイムノールフォトメッド (2018) 34:137–44. 土井:10.1111/phpp.12355
PubMed Abstract|CrossRef Full Text|Google Scholar
25. Schweintzger NA、Gruber-Wackernagel A、Shirsath N、Quehenberger F、Obermayer-Pietsch B、Wolf P.多形性光噴火患者におけるビタミンDレベルおよび規制T細胞に対する季節の影響。, Photochem Photobiol Sci. (2016) 15:440–6. doi: 10.1039/c5pp00398a
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Proby C, Baker C, Morton O, Hawk JLM. New broad spectrum sunscreen for polymorphic light eruption. Lancet (1993) 341:1347–8.
PubMed Abstract | Google Scholar
28. Allas S, Lui H, Moyal D, Bissonnette R., UV-A/UV-Bメタルハライドランプによって誘導される多形光噴火から保護するための2つの日焼け止めの能力の比較。 アーチ-デルマトール (1999) 135:1421–2.
PubMed Abstract|Google Scholar
29. Ortel B,Wechdorn D,Tanew A,Honigsmann H.多形光量における光テスト反応に対するニコチンアミドの効果。 ブラジル-デルマトール (1988) 118:669–73.
PubMed Abstract|Google Scholar
30., Caccialanza M, Percivalle S, Piccinno R, Brambilla R. Photoprotective activity of oral Polypodiumleucotomos extract in 25 patients with idiopathic photodermatoses. Photodermatol Photoimmunol Photomed. (2007) 23:46–7. doi: 10.1111/j.1600-0781.2007.00274.x
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Tanew A, Radakovic S, Gonzalez S, Venturini M, Calzavara-Pinton P. Oral administration of a hydrophilic extract of Polypodiumleucotomos for the prevention of polymorphic light eruption., J Am Acad Dermatol. (2012) 66:58–62. doi: 10.1016/j.jaad.2010.09.773
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Van Praag MCG Boom, BW, Vermeer BJ. Diagnosis and treatment of polymorphous light eruption. Int J Dermatol. (1994) 33:233–9.
Google Scholar
34. Ling TC, Clayton TH, Crawley J, Exton LS, Goulden V, Ibbotson S, et al., ソラレン-紫外線療法2015の安全かつ効果的な使用のための皮膚科医と英国の光皮膚科グループのガイドラインの英国協会。 ブル-ジェイ-デルマトール (2016) 174:24–55. 土井:10.1111/bjd.14317
PubMed Abstract|CrossRef Full Text|Google Scholar
36. Man I,Dawe RS,Ferguson J.多形光噴火のための人工硬化:十年間の経験からの実用的なポイント. フォトデジタルマトールフォトイムノールフォトメッド (1999) 15:3–4.,
PubMed Abstract | Google Scholar
37. Mastalier U, Kerl H, Wolf P. Clinical laboratory, phototest and phototherapy findings in polymorphic light eruptions: a retrospective study of 133 patients. Eur J Dermatol. (1998) 8:554–9.
PubMed Abstract | Google Scholar
38. Krutmann J, Morita A. Mechanisms of ultraviolet (UV) B and UVA phototherapy. J Invest Dermatol Symp Proc. (1999) 4:70–2.,
PubMed Abstract | Google Scholar
39. Janssens AS, Pavel S, Out-Luiting JJ, Willemze R, de Gruijl FR. Normalized ultraviolet (UV) induction of Langerhans cell depletion and neutrophil infiltrates after artificial UVB hardening of patients with polymorphic light eruption. Br J Dermatol. (2005) 152:1268–74. doi: 10.1111/j.1365-2133.2005.06690.x
PubMed Abstract | CrossRef Full Text | Google Scholar
40., Wolf P,Gruber-Wackeranagel A,Bambach i,Schmidbauer U,Mayer G,Absenger M,et al. 多形性光噴火患者の光硬化乳頭真皮における肥満細胞数を増加させながら、ベースライン表皮ランゲルハンス細胞密度を減少させます。 エクスパンション (2014) 23:428–30. 土井:10.1111/exd.12427
PubMed Abstract|CrossRef Full Text|Google Scholar
42. シュワルツA、ナビットF、スパーワッサー T、クラウゼンBE、シュワルツT。, 1,25-dihydroxyvitamin D exerts similar immunosuppressive effects as UVR but is dispensable for local UVR-induced immunosuppression. J Invest Dermatol. (2012) 132, 2762–9. doi: 10.1038/jid.2012.238
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Norris PG, Hawk JL. Successful treatment of severe polymorphous light eruption with azathioprine. Arch Dermatol. (1989) 125:1377–9.
PubMed Abstract | Google Scholar