鋼は、今日使用されている最も一般的な材料です。 その高い腐食速度–しかし、鋼は一つの大きな欠点を持っています。 従って鉄骨構造および部品の保護は大きい経済的な重要性をもつ。
鋼のための最良の腐食保護は亜鉛で得られます。 鋼の亜鉛コーティングは、バリア効果によって腐食から保護します。
- すなわち、酸素および水分が鋼表面に到達するのを防ぎます。,
- 傷、チップ、エッジなどで陰極防食を与えることにより、
亜鉛は、比較的低いガルバニック電位および腐食する傾向が高い金属である。 しかしながら、コーティングの表面が腐食生成物で迅速に覆われ、その後さらなる腐食から保護されるため、腐食速度はほとんどの環境で低い。
大気中の腐食
溶融亜鉛めっきされた物体が亜鉛浴を離れると、物体の表面はすぐに空気中の酸素によって攻撃されます。, 結果として生じる酸化物層は、腐食から保護する能力がほとんどない。 しかしながら、空気中の水および二酸化炭素は、酸化物層を亜鉛炭酸塩に急速に変化させる。 これらは非常に良好な接着性を有する密閉層を与える。 炭酸塩に水で非常に低い容解性があるので亜鉛コーティングの表面に優秀な保護を与えます。 金属光沢の元の光沢がある表面はマット、薄い灰色色によって取り替えられるために消える(イチジク。1).

図1., 純粋な亜鉛の外の層が付いている亜鉛コーティングの露出された表面。 光沢のある表面が消え、灰色の腐食生成物(亜鉛緑青と呼ばれることもある)に置き換えられます。

図。 2. 照明コラムの変色させた表面。 コーティングは表面に伸びる鉄亜鉛合金から主に成っています。 鉄は腐食の間に露出され、錆の形成につながる。 それは表面の錆だけであり、審美的な重大さだけである。,
屋外の空気には、ガス、すす、湿度(霧、露、雨、雪)、不活性で攻撃的な塵などの腐食性元素が多かれ少なかれ含まれています。 レベルは、場所や年の時間によって異なります。 亜鉛の硫酸塩および亜硫酸塩は水溶性であり、亜鉛表面への接着性が悪い。 したがって、雨によって容易に洗い流されます。 新しい亜鉛表面は空気の酸素によって攻撃するためにそれから露出され、腐食サイクルは繰り返されます。 従って硫黄酸化物を含んでいる空気の腐食はクリーンエアーのより大きいです。, しかし、近年、大気中の二酸化硫黄の量が大幅に減少し、その結果、亜鉛腐食も減少しています。
海洋環境では、亜鉛の腐食は空気の塩分の影響を受けます。 但し、海洋の空気はよい不動態化の影響を用いるマグネシウムの塩の少しを、含んでいる。 したがって、腐食は予想されるほど大きくはありません。 空気の塩分は海岸から素早く減少します。
亜鉛の腐食は多くの要因によって影響されます。, これは腐食速度のための一般に適当な公式が与えられないことを意味する。 しかし、亜鉛コーティングは、鋼を錆から保護するために、幅広い条件下で長い間使用されてきました。 多数の長期試験も実施されている。 従って異なった環境の亜鉛そして腐食率の腐食についての知識はよいです。 今日では、百年以上にわたって露出されている亜鉛コーティングの例があります。
腐食生成物の色は、腐食生成物が形成される環境によって異なります。, 海洋の環境は田園及び都市環境と比較される幾分白い腐食プロダクトを与えます。 腐食生成物は、通常、都市環境で最も暗い。
液体中の腐食
亜鉛表面は、一般に、液体中に水中に沈められたときに腐食生成物の保護層で覆われている。 しかし、液体は酸性またはアルカリ性であり得、攻撃的な物質の溶解または固体粒子を含むことができる。 液体の温度および流量も重要である。, このすべては、保護層が非常に変化する組成を有し得るか、または全く形成し得ないことを意味する。
空気中で従属的な役割を果たす電気化学腐食は、液体中でより重要である。 電気化学的腐食の程度は、液体の電気伝導度に依存し、これはより大きな領域またはより小さな領域にわたる亜鉛層の保護的影響に影響を及ぼす。
液体の水素イオン濃度指数は最も重大です。 亜鉛の腐食速度は5,5-12,5のpHの範囲で普通低く、安定しています、0そして20°C.間の温度で。, この範囲外の腐食は、通常、より急速である。
石灰とマグネシウムを含む硬水は、軟水よりも攻撃的ではありません。 二酸化炭素とともに、これらの物質は亜鉛表面に難溶性炭酸塩を形成し、亜鉛をさらなる腐食から保護する。
軟水はしばしば亜鉛を攻撃するが、塩が存在しないことは保護層を形成できないことを意味するからである。
積極的な軟水は、フィンランド、ノルウェー、スウェーデンおよび同様の環境の多くの川や湖で見つけることができます。
流量が0より大きい場合。,5m/s亜鉛表面の保護層の形成は禁じられ、腐食は加速します。
水温は腐食速度にとって非常に重要です。 およそ55°Cの上で、層形成腐食プロダクトは粗粒の構造を得、亜鉛表面への付着を失います。 それらは容易にずらされ、継続的で、急速な腐食の攻撃のための新しく、新しい亜鉛を露出する。 腐食速度は約70℃で最大に達し、その後100℃では50℃とほぼ同じになるように低下する。,
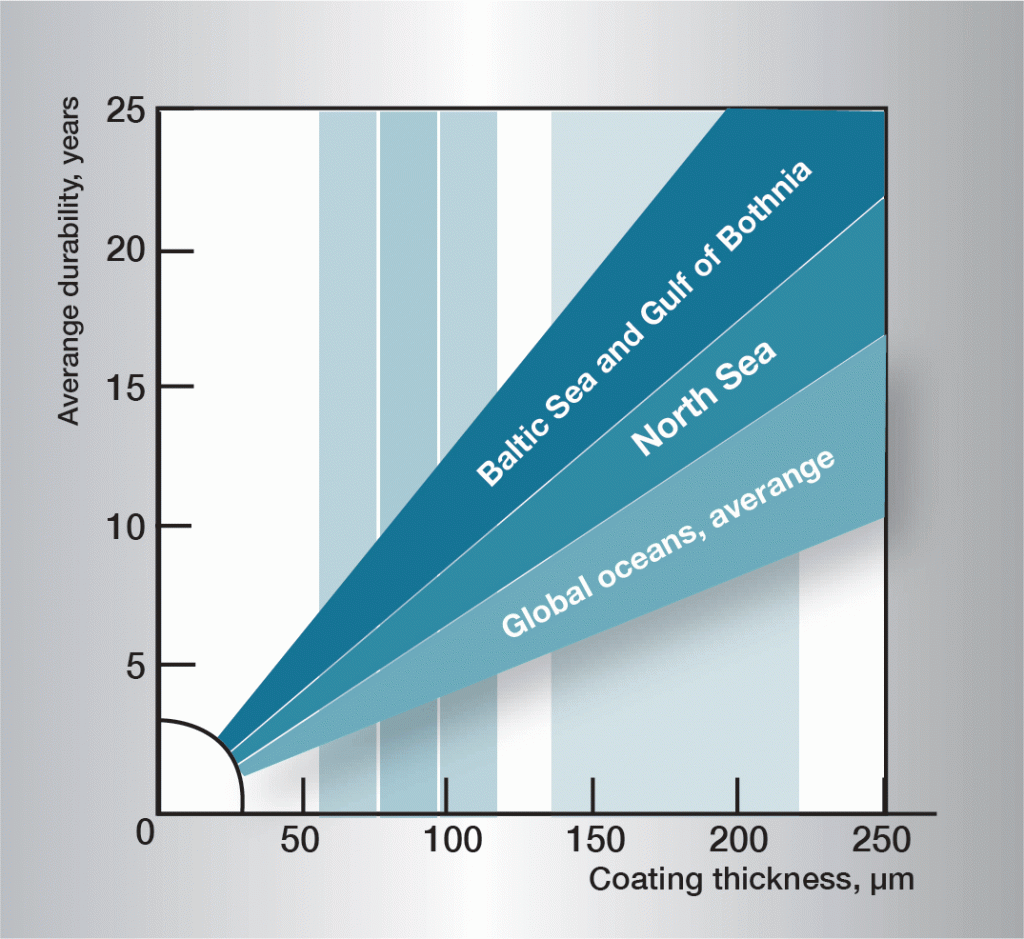
水中の腐食順序は非常に複雑であり、水の組成の非常に小さな変化によって大きく影響される。 したがって、一般的に適用可能な規則を与えることは困難です。 図3の情報は実務経験に基づいており、いくつかの異なるタイプの水のガイドラインを示しています。
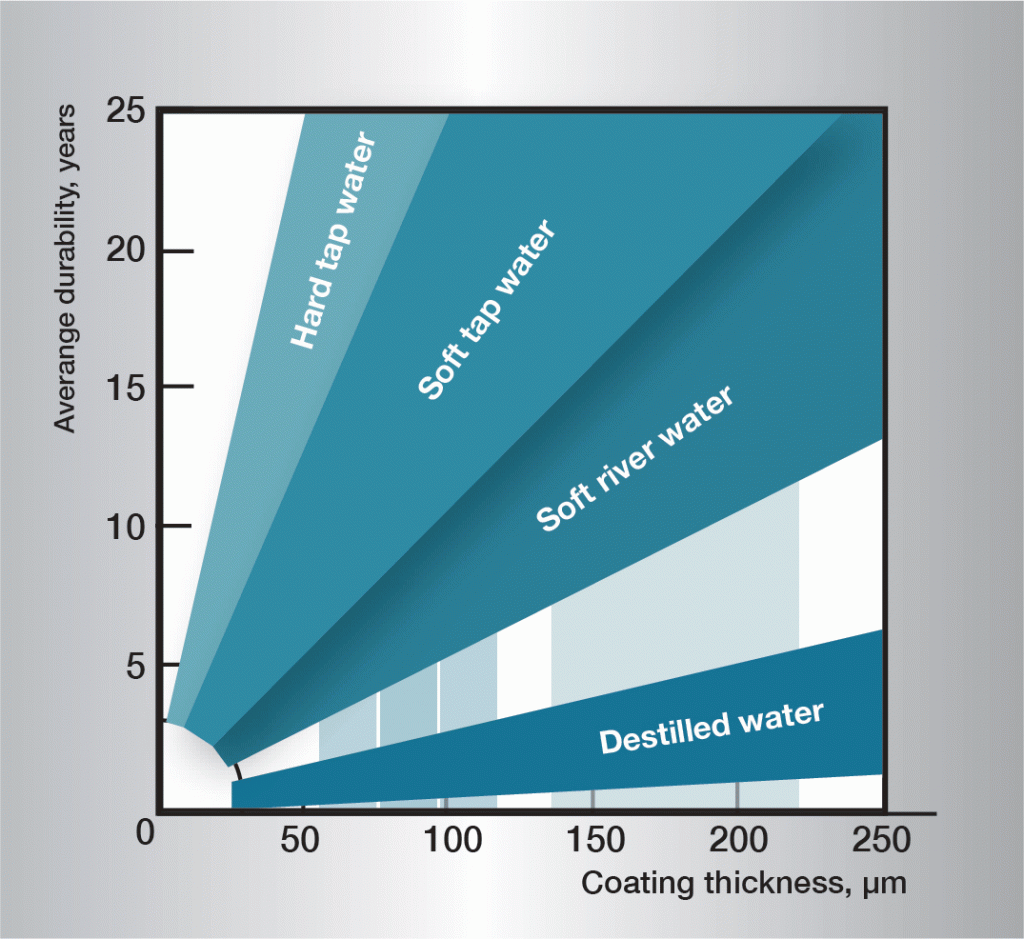
図。 3. 異なる海域でのサービス寿命。,
湿式貯蔵汚れ
亜鉛メッキされた表面には、湿式貯蔵汚れまたは白い錆と呼ばれる白くて粉っぽくてボリュームのある層が現れることがあります。4). 白色の錆びなどの素材と新めっき、光沢のある表面で、特に隙間を緊密に詰めシート角度の鉄と同様の素材です。 事前条件とは、水分がすぐに蒸発することができない条件で、材料が結露または雨水にさらされることです。, すでに腐食生成物の通常の保護層を受けている亜鉛表面はめったに攻撃されません。 亜鉛コーティングが空気にさらされると、酸化亜鉛および水酸化亜鉛が形成される。 空気中の二酸化炭素の影響下で、これらは塩基性炭酸亜鉛に変換される。 狭い隙間のように亜鉛表面への空気のアクセスが制限されている場合、その領域は炭酸塩の通常の層を形成するのに不十分な二酸化炭素を受け取 湿式貯蔵染色層は、ボリュームがあり多孔質であり、亜鉛表面にのみ緩く付着している。, その結果、継続的な攻撃に対する保護は存在しない。 従って腐食は湿気が表面に残る限り続くことができます。 ぬれ貯蔵の汚れが起こったら表面がすぐに乾燥することを可能にするために、目的は積み重なるべきです。 これにより攻撃が止まり、空気に自由にアクセスできるようになり、通常の保護層が形成されます。 ぬれ貯蔵の汚れは次第に洗い流され、コーティングは露出されたのために正常である出現、熱すくいの電流を通された鋼鉄を得る。,
この白色腐食生成物は非常にかさばります(形成された亜鉛の約500倍)ので、深刻なように見える可能性があります。 但し、ぬれ貯蔵の汚れに頻繁に腐食防止の耐用年数の重大さがほとんどありません。 しかし非常に薄いコーティングの場合には、例えば電気版の目的の、ぬれ貯蔵の汚れの厳しい攻撃は重大である場合もあります。
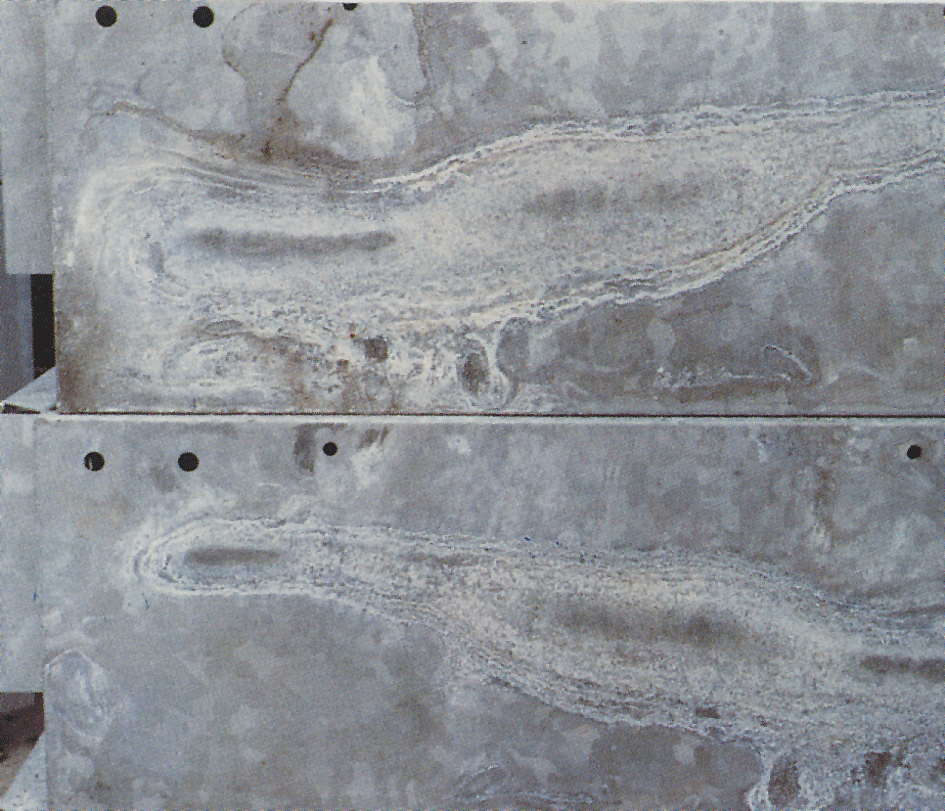
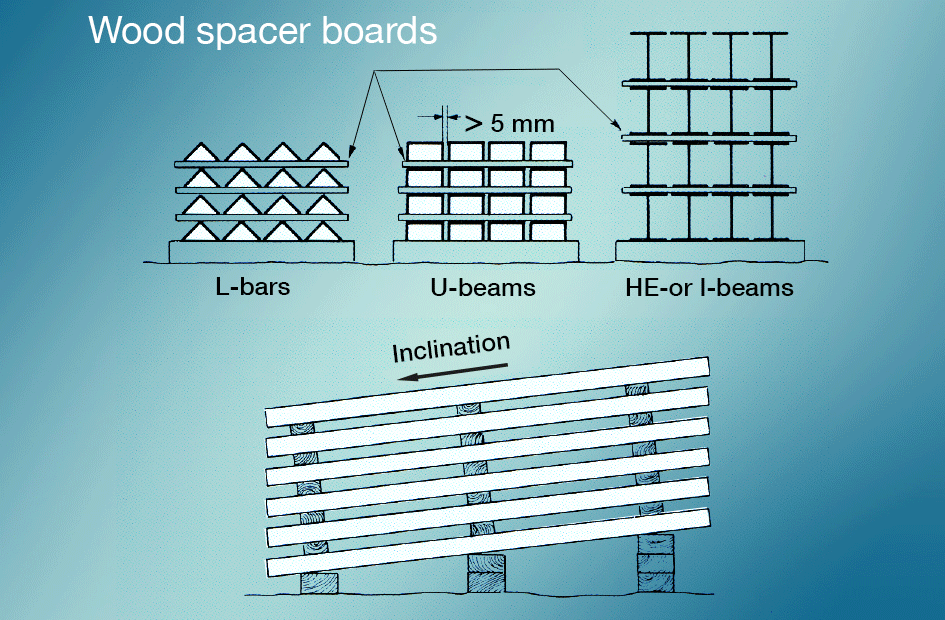
ぬれ貯蔵の汚れは交通機関の間に新しく電流を通された表面が雨または凝縮物が付いている接触に入って来ることを防ぐことによって最もよく避け, 屋外に保管されている材料は、水が簡単に流出し、すべての表面が換気されるように積み重ねる必要がありますfig. 5). 亜鉛メッキ後の塗装は非常に良好な保護を与えます。
土壌中の腐食
土壌中の腐食条件は非常に複雑であり、互いに近接していても、異なる場所の間で変化が大きくなる可能性があります。 土壌には、風化した製品、遊離または結合した塩、酸およびアルカリ、有機物の混合物、酸化または還元性真菌、微生物などが含まれることがあります。, その構造に応じて、土壌は空気および水分に対する透過性の程度が異なる。 通常、酸素content有量は空気中よりも少なく、二酸化炭素content有量はより高い。
スウェーデンの土壌は一般的にあまり積極的ではありません。 亜鉛の平均腐食は、通常、年間5μmとして取られます。 厳しく攻撃的な土壌はめったに見られない。 北および西Bothniaでは、土壌に硫黄が含まれている場合があります。 彼らはしばしば黒いが、空気にさらされると明るくなる。 これらの土壌では、亜鉛腐食速度は非常に高い。
土壌の腐食性を決定する一つの方法は、その抵抗率を測定することである。, 土壌のサイズを決定できない場合、図6に示す経験則によって、ガイダンスの尺度が得られます。 しかし、土壌への金属の暴露に関する場合は、適切な資格のある情報源から専門家の助言を求めることをお勧めします。

ガルバニック腐食

電解質に完全または部分的に囲まれた二つの異なる金属または合金が接続されている どの金属が陽極または陰極になるかは、問題の電解質中のそれらの電極電位によって決定される。 実際の条件の大部分に対応する海水では、いくつかの金属および合金は、図7に示す電気化学スケールで異なる位置を占める。,
鋼が銅または黄銅に接続されている場合、鋼はセル内の陽極になり、腐食します。 しかし、鋼がカドミウム、アルミニウム、亜鉛またはマグネシウムに接続されている場合、それは陰極になり、腐食から保護され、陽極金属は消費される。 ガルバニック腐食はまた陰極防食と名づけられるときバイメタル腐食と呼ばれ、腐食から水中構造を保護するのに使用されています。
亜鉛コーティングによってできられる陰極防食
熱すくいの電流を通された鋼鉄では、亜鉛および鋼鉄はよい電気contactに互いにあります。, 亜鉛コーティングが電解物の前で傷つけられればガルバニック細胞は作成される。 電解質は凝縮物または雨水である可能性がある。 場合によっては、構造全体を液体に浸すことができます。 従ってこの細胞で亜鉛は陽極または分解の棒になります、露出された鋼鉄は陰極になり、腐食から保護されます。
初期段階では、コーティングが損傷した鋼表面の露出部分に弱いust形成が見られることがよくありますが、しばらくすると白っぽい灰色の領域が, 亜鉛コーティングは腐食し、控えめに溶ける亜鉛合金は継続的だった錆の攻撃から鋼鉄を保護する陰極の表面に降ります。 これは頻繁に亜鉛層が、当然、元通りにならないので誤った名称の何かである”自己回復”と呼ばれます。
亜鉛によって発生する陰極防食のために錆は鋼鉄より気高い金属のペンキまたはコーティングのフィルムの下でクリープできるように損傷の点でコーティングの下で”クリープ”できません。, 鋼鉄の亜鉛コーティングはコーティングへの損傷のかなり大きい区域が錆の保護の壊滅的な損失を引き起こさないので、珍しいです。 陰極防食の範囲は、セルを生成する電解質の性質に依存する。 正常な大気の構造のために数ミリメートル上の保護行為を期待することは通常です。 しかし、海水ではかなり大きな距離が期待できます。
非鉄金属と接触する亜鉛コーティング
電気化学ポテンシャルスケールは、亜鉛が最も一般的な金属よりも高貴でないことを示しています。 これは亜鉛がガルバニック細胞のこれらの金属に接続されるとき分解の棒になる亜鉛であることを意味します。 原則として、そのため、接続は避けることが可能です。 良い方法は、接合部にプラスチックやゴムなどの絶縁体を使用することです。,
アルミニウムおよびステンレス鋼は頻繁に起こる顕著な腐食なしで空気またはかなり乾燥した環境の電流を通された材料に直接接続すること しかし、水中では常に絶縁体を使用する必要があります。
銅および銅合金はより電気的に活性であり、しばしば大きな表面に広がり、顕著な攻撃を引き起こす銅イオンの放出がある。 このため、これらの金属は、絶対に許してはならないとの接触の亜鉛めっき鋼板、絶縁体を使用すること。,
モルタル、石膏および木材と接触する溶融亜鉛めっき鋼
湿ったモルタルおよび石膏攻撃亜鉛。 材料が乾燥すると攻撃は止まります。 乾燥したか適度に湿気がある木は、浸透させ、unimpregnatedよい効果に熱すくいの電流を通された釘によって、釘付けすることができます。 しかしながら、水に常に曝されている釘またはねじ組合の場合には、耐酸性材料が好ましい。 他の乾燥した建築材料は、ミネラルウールのような、亜鉛を攻撃しない。,
亜鉛めっき鋼の梱包と輸送
溶融亜鉛めっきコーティングはかなり粗い処理に耐えることができますが、保管および輸送中は注意して取り 長い商品の場合には束への簡単なパッキングそして結合は機械損傷からだけでなく、保護するが、頻繁に交通機関自体を促進する。 但し、パッキングおよび結合はぬれた貯蔵の緊張の危険を避けるために方法でされるべきです。 スペーサー使用の防止など。