ハーバープロセスの概要
ハーバープロセスは、空気からの窒素と主に天然ガス(メタン)から得られる水素 この反応は可逆的であり、アンモニアの生成は発熱性である。,
![]()
![]()
ハーバープロセスのフロースキームは次のようになります。
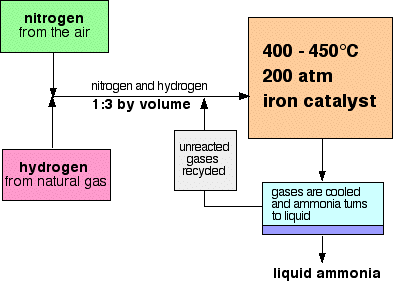
条件に関するいくつかの注意事項
触媒
触媒は、実際には純粋な鉄よりもわずかに複雑です。 それは、その効率を高める物質であるプロモーターとして水酸化カリウムを添加しています。
圧力
圧力はある製造プラントによって異なりますが、常に高いです。 200気圧の試験では間違ってはいけません。,
リサイクル
反応器を通るガスの各パスで、窒素と水素の約15%だけがアンモニアに変換されます。 (この数字はまた、植物によって異なります。)未反応の窒素および水素の絶え間ないリサイクルによって、全面的な転換は約98%です。
条件を説明する
窒素と水素の比率
反応器に入る窒素と水素の混合物は、1体積の窒素と3体積の水素の比率である。,
アボガドロの法則は、同じ温度と圧力で同じ量のガスが同じ数の分子を含んでいると言います。 つまり、ガスは1分子の窒素と3分子の水素の比率で反応器に入っていることを意味します。
それは方程式によって要求される割合です。
いくつかの反応では、反応物のいずれかの過剰を使用することを選択することができます。 他の反応物をできるだけ使い切ることが特に重要な場合は、これを行います-例えば、それがはるかに高価であった場合。 それはこの場合には適用されません。,
方程式の比率以外のものを使用するには、常に欠点があります。 あなたが一つの反応物質の過剰を持っている場合は、それらが反応するためのものがないので、おそらく反応することができない反応器を通過する これは、反応器の空間、特に触媒表面の空間を無駄にする。
温度
平衡に関する考慮事項
平衡混合物中の最大可能量のアンモニアを生成するためには、平衡の位置をできるだけ右にシフトする必要があります。,
前方反応(アンモニアの生成)は発熱である。
![]()
![]()
Le Chatelierの原則によれば、温度を下げるとこれが好まれます。 システムなどの対応の位置を移動して均衡に対抗すなわち作ります。
平衡混合物中でできるだけ多くのアンモニアを得るためには、できるだけ低い温度が必要です。 しかし、400-450°Cは低温ではありません!,
レートに関する考慮事項
使用する温度が低いほど、反応が遅くなります。 製造業者は一日あたりできるだけ多くのアンモニアを生産しようとしています。 反応がその平衡に達するまでに数年かかる場合、非常に高い割合のアンモニアを含む平衡混mixtureを達成しようとするのは意味がありません。
反応器内の触媒と接触する非常に短い時間内にガスが平衡に達する必要があります。,
妥協点
400-450°Cは、平衡混合物中のアンモニアの割合がかなり高い(たとえそれがわずか15%であっても)が、非常に短い時間で生成する妥協点温度である。
圧力
平衡に関する考慮事項
![]()
![]()
方程式の左側には4つの分子があり、右側には2つしかないことに注意してください。,
Le Chatelierの原理によれば、圧力を上げると、システムはより少ない分子を生成する反応を支持することによって反応する。 それは圧力が再び落ちる原因となります。
平衡混合物中でできるだけ多くのアンモニアを得るためには、できるだけ高い圧力が必要です。 200気圧は高圧ですが、驚くほど高くはありません。
速度に関する考慮事項
圧力を上げると分子が近づきます。, この特定の例では、それは反応してもいい触媒の表面に当り、付くことのチャンスを高めます。 圧力が高ければ高いほど、ガス反応の速度に関してはより良い。
経済的な考慮事項
非常に高い圧力は、二つのカウントで生産するのに非常に高価です。
あなたは非常に高い圧力に耐えるために非常に強力なパイプと格納容器を構築する必要があります。 それは植物が造られるときあなたの資本コストを増加させる。
高圧は生産および維持に多くの費用がかかります。, それはあなたの植物の運営費用が非常に高いことを意味する。
妥協
200気圧は、経済的根拠に基づいて選択された妥協圧力です。 使用される圧力が高すぎる場合、それを生成するコストは、生成された余分なアンモニアのために得ることができる価格を超えます。
触媒
平衡に関する考慮事項
触媒は平衡の位置に何の影響も与えません。 触媒を加えることは平衡の混合物のアンモニアのより大きいパーセントを作り出さない その唯一の機能は、反応をスピードアップすることです。,
速度に関する考慮事項
触媒が存在しない場合、反応は非常に遅く、任意の賢明な時間において実質的に反応は起こらない。 触媒は、反応がガスが実際に反応器内にある非常に短い時間内に動的平衡を設定するのに十分な速さであることを保証する。
アンモニアを分離する
ガスが反応器を離れるとき、それらは高温で非常に高圧である。, アンモニアは、それがあまりにも熱くない限り、圧力下で容易に液化されるので、混合物の温度は、アンモニアが液体に変わるのに十分に低下する。 窒素と水素はこれらの高圧下でもガスとして残り、リサイクルすることができます。
あなたの理解をテストするための質問
これがあなたが行った質問の最初のセットである場合は、開始する前に入門ページをお読みください。 その後ここに戻ってくるには、ブラウザの戻るボタンを使用する必要があります。,
Haberプロセスに関する質問
回答
今どこに行きたいですか?
平衡メニューに移動します。 . .
物理化学メニューに移動します。 . .
メインメニューへ。 . .