原子と光エネルギー
原子とその特性の研究は、いくつかの異なる科学 化学者、物理学者、天文学者はすべて、宇宙の多くが”より大きな絵”を見つけるために機能する顕微鏡スケールを理解しなければなりません。,
原子の中
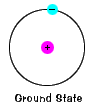 |
電子の基底状態は、それが通常占めるエネルギー準位であり、その電子の最も低いエネルギーの状態です。 |
| 各電子が持ち、まだその原子の一部であることができる最大エネルギーもあります。 そのエネルギーを超えて、電子はもはや原子の核に結合しておらず、イオン化されていると考えられています。, | 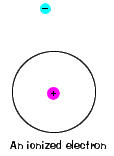 |
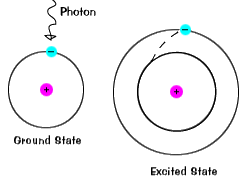 |
電子が一時的にそのグラウンド状態よりも大きいエネルギー状態を占めると、電子は励起状態にあります。state.An 電子は、光子や光のパケットを吸収したり、近くの原子や粒子と衝突したりするなど、余分なエネルギーが与えられた場合に励起される可能性がありま |
光エネルギー
このページのイラストは、もちろん、実際の原子の簡易版です。 実際の原子は、水素のような比較的単純なものでさえ、多くの異なる軌道を持っているので、異なる初期状態と最終状態で多くの可能なエネルギーがあ, 原子が励起状態にあるとき電子は一度に基底状態に至るまでずっと落ちるか、中間レベルで途中で止まることができます。
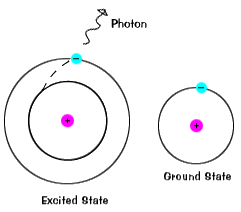 |
電子は非常に長い間励起状態にとどまらず、すぐに基底状態に戻り、吸収されたものと同じエネルギーで光子を放出します。, |
個々のタイプの原子を識別する
エネルギーレベルは原子核の陽子と中性子によって一意に決定されるため、様々な軌道間の遷移は要素ごとに一意である。 我々は、異なる要素が異なる数の陽子および中性子をそれらの核内に含む。 ある原子の電子がより低い軌道に戻るとき励起状態から、それらが放出する光子は、その種の原子の特徴であるエネルギーを有する。, これにより、それぞれ要素に固有の指紋が与えられ、要素を識別することが可能になりますガスの容器内に存在する、または星でさえあります。
元素の周期表のようなツールを使用して正確に把握することができますどのように多くの陽子、したがって電子、原子が持っています。 まず第一に、我々は知っている原子が中性電荷を持つためには、それは同じ数の陽子と電子を持たなければならないということです。 原子が電子を失ったり、得たりすると、イオン化されたり、帯電したりします。 周期表は私たちに原子番号を与えるでしょう元素。 原子番号は、原子がどれくらいの陽子を持っているかを教えてくれます。, 例えば、水素は一つの原子番号を持っています-つまり、一つの陽子、したがって一つの電子-そして実際には中性子を持っていません。
学生のために
原子の前の説明に基づいて、水素原子のアモデルを描きます。 原子の”標準”モデルは知られているBohrモデル。
数によってのみ異なる同じ化学元素の異なる形態それらの核内の中性子の同位体と呼ばれる。 ほとんどの元素は、天然に存在する同位体よりも多い。, さらに多くの同位体が原子炉や科学研究所で生産されています。 通常、同位体はあまり安定ではなく、より安定なものが形成されるまで放射性崩壊を受ける傾向がある。 あなたはelementuraniumに精通しているかもしれません-それはいくつかの不安定な同位体を持っており、U-235は最も一般的に知られているものの一つです。 235は、この形式のウランが235のニュートロンと陽子を組み合わせていることを意味します。 ウランの原子番号を調べて235から引いた場合、同位体が持つ中性子の数を計算することができます。,
ここでは別の例です-炭素は通常、C-12(炭素-12)、すなわち6つの陽子と6つの中性子の形で発生しますが、一つの同位体はC-13であり、6つの陽子と7
学生のために
周期表と以下の元素の名前を使用して、陽子、中性子、電子がいくつあるかを調べます。シリコン-28、マグネシウム-24、硫黄-32、酸素-16、およびヘリウム-4の元素の原子のモデルを描きます。,
学生のために
テキストを使用して、次の用語を定義します:エネルギー準位、吸収、放出、励起状態、基底状態、イオン化、原子、元素、原子質量、原子番号、同位体。
原子の量子力学的性質に関するオプションのノート上記のボーア原子は原子の構造について学ぶための良い方法ですが、それらをモデル化する最も正確な方法ではありません。, 各軌道は正確なエネルギーを持っていますが、電子は現在、核を取り巻く”電子雲”に塗りつぶされていると想定されています。 電子の半径として、電子までの平均距離を話すのが一般的である。orbit.So ただ覚えておいてください、私たちは”軌道”と”軌道”という言葉を残しますが、平らな軌道面ではなく、電子が存在する確率がある領域を記述するためにそれらを使用していません。 電子は、核と電子との間の電気的引力によって核の近くに保持される。,これらの惑星は、銀河の代わりに太陽の近くにとどまるのと同じようにそこに保管されています。 太陽系とは異なり、すべての惑星の軌道同じ平面上にあり、電子軌道はより三次元である。 それぞれ原子上のエネルギーレベルは異なる形状を有する。 その軌道内の電子の位置の確率を教えてくれる数学的方程式があります。 水素原子は、すでにBohrモデルを描いています。,
このセクションのテキストと画像は、Dave SlavenのAtomのページから適応されました(以下の参考文献を参照)。 |

