グリコシド結合形成
さて、生化学的な文脈でアセタール形成を考えてみましょう。 生化学におけるアセタール/ケタール基の非常に重要な例は、個々の糖モノマーを連結して多糖類を形成するグリコシド結合である(簡単なレビューについては1.3項を参照)。, セルラーゼ鎖における二つのグルコースモノマー間のグリコシド結合を見てください:
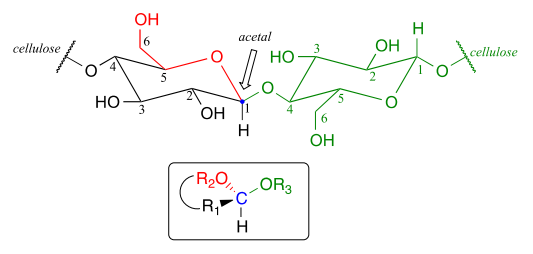
注意深く見ると、左側のグルコースモノマーのアノマー炭素である炭素#1がアセタール基の中心炭素であることを認識する必要があります。 生化学者はこれをb-1,4結合と呼び、炭素#1の立体化学は特殊炭水化物の命名系においてbであり、鎖上の次のグルコースの炭素#4にリンクされてい, 炭水化物の広大な構造的多様性は、二つの炭素が結合しているという点でも、結合の立体化学でも、可能な異なる結合から大きく生じています。 炭水化物の生化学をより深く研究すると、グリコシド結合結合パターンのより多くのバリエーションが表示されます。,
新しいグリコシド結合が形成される反応は、グリコシルトランスフェラーゼと呼ばれる酵素によって触媒され、有機化学の用語では、これらの反応はヘミアセタールからアセタールへの変換を表す(環状形態の糖モノマーはヘミアセタールおよびヘミケタールであることを覚えておいてください)。, 生きている細胞におけるグリコシド結合形成のメカニズムは、酸触媒による(非生物学的)アセタール形成メカニズムと並行しており、重要な違いは、プロトン化されるのではなく、ヘミアセタールの\(OH\)基がリン酸化によって良好な脱離基に変換されることである(これは第9章と第10章からよく知られているパターンである)。 活性化リン酸基の特異的同一性は、異なる反応によって異なるので、下の図で一般化される。,
機構(生化学)アセタールの形成
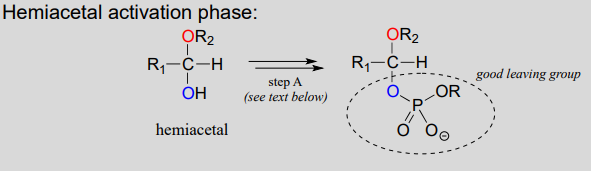
- テキス(アクティベーションの位相):この相反応によって異なるので、特定の場合、 でも、リン酸基転送手順に精通しているから第9章 しかし,現在の議論にとって最も重要なのは,ヘミアセタール上のヒドロキシル基が活性化されていることである。 -リン酸化によって-よい去るグループに作られる。,
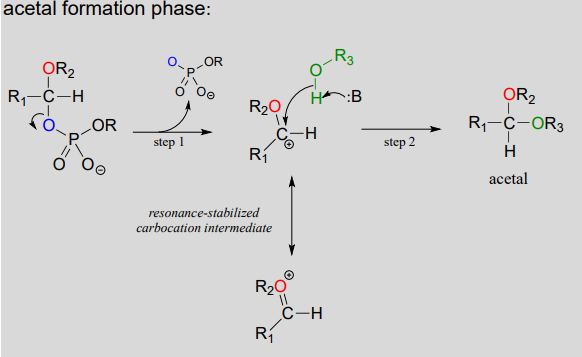
- ステップ1:脱離基が活性化されたので、脱離基はその仕事をして脱離し、共鳴安定化されたカルボカチオンをもたらす。
- ステップ2:成長するセルロース鎖上の求核アルコールは、アセタールを形成するために非常に求電子性のカルボカチオンを攻撃する。 ここで新しいグリコシド結合の立体化学が決定される:反応に応じて、アルコール求核剤は平面カルボカチオンのいずれかの側から接近することができる。,
繰り返すために:ここで遊んでおなじみの\(S_N1\)メカニズムパターンを認識することが重要です:ステップAでは、貧しい脱離基が良い脱離基に変換され、ステップ1で脱離基が残り、安定化されたカルボカチオンが残され、ステップ2で求核剤が攻撃して新しい結合を形成し、置換プロセスを完了する。 この機械的な接続を行うのに問題がある場合は、第8章で見た\(S_N1\)の反応を振り返ってみてください。,
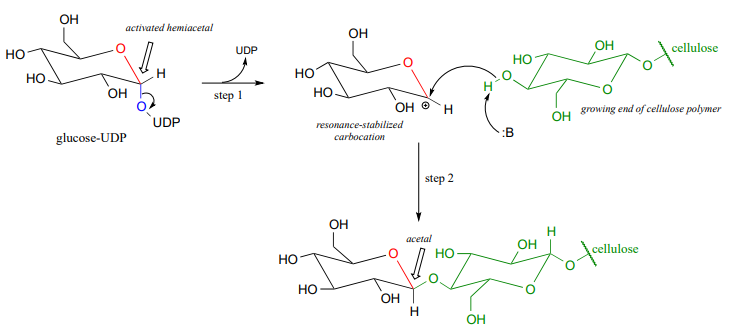
さて、成長するセルロース鎖上に新しいグリコシド結合が形成されるグリコシルトランスフェラーゼ反応機構を具体的に見てみましょう。 ステップA1、問題P9.13の反応と同様のメカニズムを持つリン酸異性化反応、続いてUTP依存ステップA2、問題P9.12のメカニズムを提案するために招待された。,
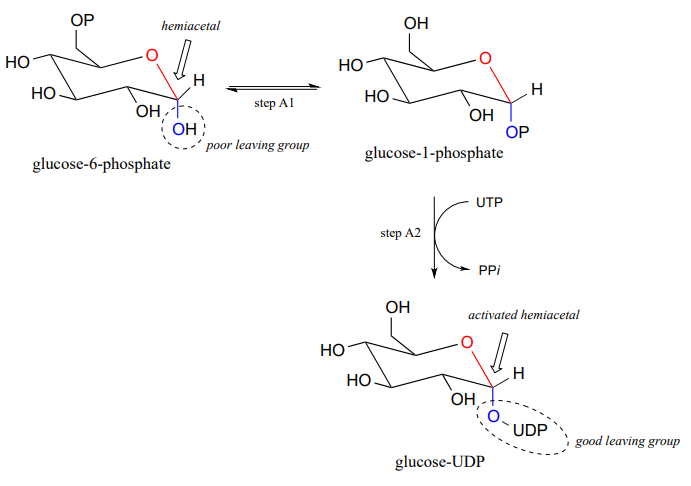
グルコース-UDP上のUDP基は次いで離れ(以下のステップ1)、共鳴安定化カルボカチオン中間体を形成する。 ステップ2で成長するセルロース鎖上のアルコール基による攻撃は、グリコシド(アセタール)結合を形成する。 立体化学の反転に注意してください。