Nucleophile Substitution der Hydroxylgruppe
Das chemische Verhalten von Alkylhalogeniden kann als Referenz bei der Entdeckung analoger Substitutions-und Eliminationsreaktionen von Alkoholen verwendet werden. Der Hauptunterschied ist natürlich eine Veränderung des Austrittsanions von Halogenid zu Hydroxid. Da Sauerstoff etwas elektronegativer ist als Chlor (3,5 vs. 2,8 auf der Pauling-Skala), wird erwartet, dass die C-O-Bindung polarer ist als eine C-Cl-Bindung., Darüber hinaus zeigt ein unabhängiges Maß für die elektrophilen Eigenschaften von Kohlenstoffatomen aus ihren NMR-chemischen Verschiebungen (sowohl 13C-als auch Alpha-Protonen), dass Sauerstoff-und Chlorsubstituenten einen ähnlichen elektronenabziehenden Einfluss ausüben, wenn sie an sp3-hybridisierte Kohlenstoffatome gebunden sind. Trotz dieser vielversprechenden Hintergrundbeweise unterliegen Alkohole nicht den gleichen SN2-Reaktionen, die üblicherweise bei Alkylhalogeniden beobachtet werden. Zum Beispiel hat die schnelle SN2-Reaktion von 1-Brombutan mit Natriumcyanid, wie unten gezeigt, keine Parallele, wenn 1-Butanol mit Natriumcyanid behandelt wird., Tatsächlich wird Ethylalkohol häufig als Lösungsmittel für solche Alkylhalogenidsubstitutionsreaktionen verwendet.
CH3CH2CH2CH2–Br + Na (+), CN(–)  CH3CH2CH2CH2–CN + Na(+) Br(–)
CH3CH2CH2CH2–CN + Na(+) Br(–)
CH3CH2CH2CH2–OH + Na (+), CN(–)  Keine Reaktion
Keine Reaktion
Der entscheidende Faktor hier ist die Stabilität des verlassen-anion (Bromid vs. hydroxide)., HBr ist eine viel stärkere Säure als Wasser (um mehr als 18 Größenordnungen), und dieser Unterschied spiegelt sich in Reaktionen wider, die ihre jeweiligen konjugierten Basen erzeugen. Die schwächere Base, Bromid, ist stabiler und ihre Freisetzung in einer Substitutions-oder Eliminationsreaktion ist viel günstiger als die von Hydroxidion, einer stärkeren und weniger stabilen Base.
Ein klarer Schritt zur Verbesserung der Reaktivität von Alkoholen bei SN2 –Reaktionen wäre, die-OH-Funktionsgruppe so zu modifizieren, dass ihre Stabilität als leaving Anion verbessert wird., Eine solche Modifikation besteht darin, die Substitutionsreaktion in einer starken Säure durchzuführen und –OH in –OH2 (+) umzuwandeln. Da das Hydroniumion (H3O (+)) eine viel stärkere Säure als Wasser ist, ist seine konjugierte Base (H2O) eine bessere chemische Gruppe als Hydroxidion. Das einzige Problem bei dieser Strategie ist, dass viele Nukleophile, einschließlich Cyanid, durch Protonierung in starken Säuren deaktiviert werden, wodurch das für die Substitution erforderliche nukleophile Co-Reaktant wirksam entfernt wird., Die starken Säuren HCl, HBr und HI unterliegen dieser Schwierigkeit nicht, da ihre konjugierten Basen gute Nukleophile sind und noch schwächere Basen als Alkohole sind. Die folgenden Gleichungen veranschaulichen einige Substitutionsreaktionen von Alkoholen, die von diesen Säuren beeinflusst werden können. Wie bei Alkylhalogeniden verläuft die nukleophile Substitution von 1º-Alkoholen durch einen SN2-Mechanismus, während 3º-Alkohole durch einen SN1-Mechanismus reagieren. Reaktionen von 2º-Alkoholen können durch beide Mechanismen auftreten und oft einige neu angeordnete Produkte produzieren., Die Zahlen in Klammern neben den Mineralsäureformeln stellen den Gewichtsprozentsatz einer konzentrierten wässrigen Lösung dar, der Form, in der diese Säuren normalerweise verwendet werden.
Obwohl diese Reaktionen manchmal als“ säurekatalysiert “ bezeichnet werden, ist dies nicht unbedingt korrekt. Bei der Gesamtumwandlung wird eine starke HX-Säure in Wasser umgewandelt, eine sehr schwache Säure, so dass zumindest eine stöchiometrische Menge an HX für eine vollständige Umwandlung von Alkohol in Alkylhalogenid erforderlich ist., Die Notwendigkeit, bei dieser Reaktion äquivalente Mengen sehr starker Säuren zu verwenden, begrenzt ihre Nützlichkeit auf einfache Alkohole des oben gezeigten Typs. Alkohole mit säureempfindlichen Gruppen tolerieren eine solche Behandlung natürlich nicht. Dennoch kann die Idee, die-OH-Funktionsgruppe zu modifizieren, um ihre Stabilität als Leaving Anion zu verbessern, in andere Richtungen verfolgt werden. Das folgende Diagramm zeigt einige Änderungen, die sich als wirksam erwiesen haben. In jedem Fall wird die Hydroxylgruppe in einen Ester einer starken Säure umgewandelt. Die ersten beiden Beispiele zeigen die zuvor beschriebenen Sulfonatester., Das dritte und vierte Beispiel zeigen die Bildung eines Phosphitesters (X steht für die verbleibenden Brome oder zusätzlichen Alkoholsubstituenten) bzw. eines Chlorosulfitesters. Alle diese Ausscheidungsgruppen (blau gefärbt) haben Konjugatsäuren, die viel stärker sind als Wasser (um 13 bis 16 Zehnkräfte); Somit ist das Ausscheidungsanion entsprechend stabiler als das Hydroxidion. Die Mesylat – und Tosylatverbindungen sind besonders nützlich, da sie bei Substitutionsreaktionen mit einer Vielzahl von Nukleophilen eingesetzt werden können., Die Zwischenprodukte, die in Reaktionen von Alkoholen mit Phosphortribromid und Thionylchlorid hergestellt werden (letzte zwei Beispiele), werden selten isoliert, und diese Reaktionen produzieren weiterhin Alkylbromid-und Chloridprodukte.
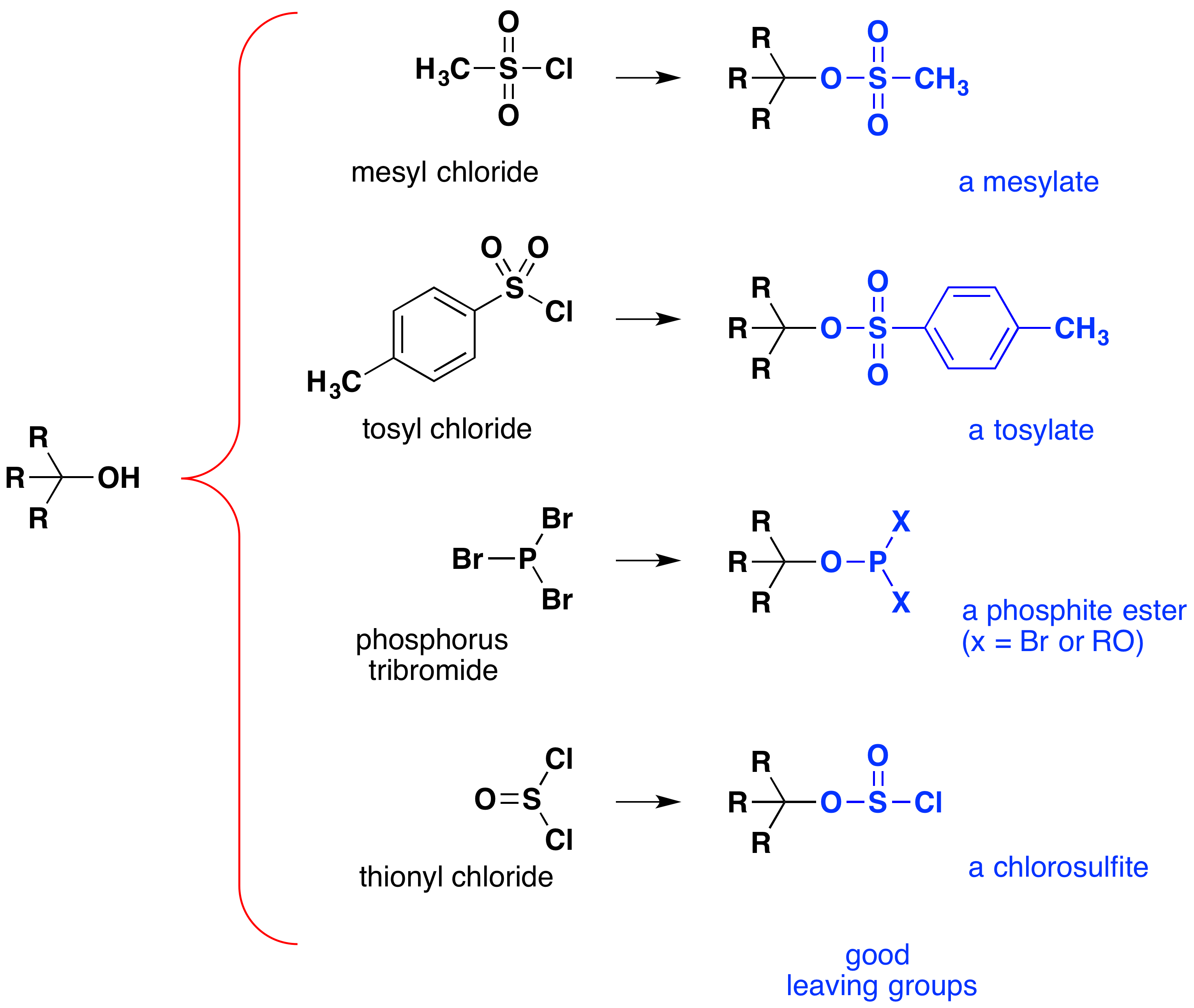
Die Bedeutung von Sulfonatester-Zwischenprodukten bei allgemeinen nukleophilen Substitutionsreaktionen von Alkoholen kann durch die folgende Umwandlung von 1-Butanol in Pentanenitril (Butylcyanid) veranschaulicht werden, eine Reaktion, die nicht allein mit dem Alkohol auftritt., Die Phosphor-und Thionylhalogenide hingegen wirken nur zur Umwandlung von Alkoholen in die entsprechenden Alkylhalogenide.,
| CH3CH2CH2CH2–OH + CH3SO2Cl | pyridine
|
CH3CH2CH2CH2–OSO2CH3 | Na(+) CN(–)
|
CH3CH2CH2CH2–CN + CH3SO2O(–) Na(+) |
Some examples of alcohol substitution reactions using this approach to activating the hydroxyl group are shown in the following diagram., Die ersten beiden Fälle dienen dazu, die Tatsache zu verstärken, dass Sulfonatesterderivate von Alkoholen Alkylhalogenide in einer Vielzahl von SN2-Reaktionen ersetzen können. Die nächsten beiden Fälle zeigen die Verwendung von Phosphortribromid bei der Umwandlung von Alkoholen in Bromide. Dieses Reagenz kann ohne Zusatz von Base (z. B. Pyridin) verwendet werden, da das Phosphorsäureprodukt eine schwächere Säure als HBr ist. Phosphortribromid wird am besten mit 1º-Alkoholen verwendet, da 2º-Alkohole häufig Umlagerungsnebenprodukte ergeben, die aus konkurrierenden SN1-Reaktionen resultieren., Beachten Sie, dass der Äthersauerstoff in Reaktion 4 von diesem Reagenz nicht beeinflusst wird, während die alternative Synthese unter Verwendung von konzentriertem HBr Ether spaltet. Phosphortrichlorid (PCl3) wandelt Alkohole in ähnlicher Weise in Alkylchloride um, aber Thionylchlorid wird normalerweise für diese Umwandlung bevorzugt, da die anorganischen Produkte Gase sind (SO2 & HCl). Phosphortriiodid ist nicht stabil, kann aber in situ aus einer Mischung aus rotem Phosphor und Jod erzeugt werden und wirkt zur Umwandlung von Alkoholen in Alkyliodide., Das letzte Beispiel zeigt die Reaktion von Thionylchlorid mit einem chiralen 2º-Alkohol. Das Vorhandensein einer organischen Base wie Pyridin ist wichtig, da es eine erhebliche Konzentration an Chloridionen liefert, die für die endgültige SN2-Reaktion des Chlorosufit-Zwischenprodukts erforderlich ist., In Abwesenheit einer Base zersetzen sich Chlorosufite beim Erhitzen, um das erwartete Alkylchlorid unter Beibehaltung der Konfiguration zu erhalten
Tertiäre Alkohole werden nicht üblicherweise für Substitutionsreaktionen des hier diskutierten Typs verwendet, da SN1 – und E1-Reaktionspfade dominant sind und schwer zu kontrollieren sind.

Die Bedeutung von Sulfonatestern als Zwischenprodukte bei vielen Substitutionsreaktionen kann nicht überbewertet werden., Ein strenger Beweis für die Konfigurationsinversion, die an der Substitutionsstelle bei SN2-Reaktionen auftritt, nutzt solche Reaktionen. Ein Beispiel für einen solchen Beweis wird unten angezeigt. Abkürzungen für die am häufigsten verwendeten sulfonyl-Derivate sind in der folgenden Tabelle gegeben.
| Sulfonylgruppe | CH3SO2– | CH3C6H4SO2– | BrC6H4SO2– | CF3SO2– |
|---|---|---|---|---|
| Name & Abbrev., | Mesyl oder Ms | Tosyl oder Ts) | Brosyl oder Bs | Trifyl oder Tf |
Inversion Proof

Für eine vollständige Diskussion von hydroxyl-substitution Reaktionen und eine Beschreibung der weiteren selektive Verfahren für diese Umwandlung, Klicken Sie Hier.
Mitwirkende
- William Reusch, emeritierter Professor (Michigan State U.,), Virtual Textbook of Organic Chemistry