Atomok, Fény, Energia
A tanulmány az atomok, illetve azok jellemzői átfedés több differentsciences. A kémikusoknak, fizikusoknak és csillagászoknak mind meg kell érteniük, hogy a világegyetem nagy része milyen méretekben működik, hogy “nagyobb képet” láthasson.,
az Atom belsejében
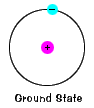 |
egy elektron földi állapota, az általa elfoglalt energiaszint az elektron legalacsonyabb energiájának állapota. |
| van egy maximális energia is, amelyet minden elektron képesés még mindig része az atomjának. Ezen az energián túl az elektron már nem kötődik az atom magjához, és úgy tekintik, hogy ionizálódik., | 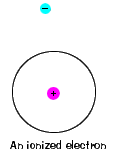 |
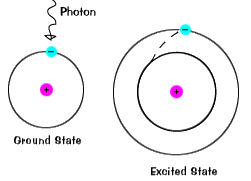 |
Ha egy elektron ideiglenesen foglal egy energia állam nagyobb, mint itsground, az állami, egy izgatott állapotban.Egy elektron válhat izgatott, ha az adott extra energiát, mint ha itabsorbs egy foton, vagy csomag a fény, vagy ütközik egy közeli atom vagy részecske. |
fényenergia
az ezen az oldalon található illusztrációk természetesen a valódi atomok egyszerűsített változatai. A valódi atomoknak, még egy viszonylag egyszerűnek is, mint például a hidrogénnek, sok különböző pályája van, így sok lehetséges energia van különböző kezdeti és végső állapotokkal., Amikor egy atom izgatottállam, az elektron egy menetben teljesen leeshet a talaj állapotába, vagy megállhat az úton egy közbenső szinten.
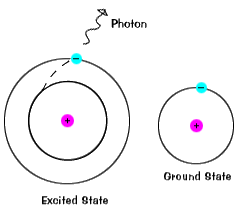 |
Elektronok ne maradjon izgatott államok sokáig, ők soonreturn, hogy a föld kimondja, hogy a kibocsátott foton a sameenergy, mint a szívódik fel., |
az atomok egyes típusainak azonosítása
a különböző orbitálok közötti átmenetek egyediek minden egyes elem esetében, mivel az energiaszinteket a thenucleusban lévő protonok és neutronok egyedileg határozzák meg. Tudjuk, hogy a különböző elemek különböző számú protonok és neutronok vannak a magjukban. Amikor egy adott atom elektronjai visszatérnek az alacsonyabb pályákraa gerjesztett állapotokból az általuk kibocsátott fotonok olyan energiákkal rendelkeznek, amelyek vannakaz ilyen típusú atomra jellemző., Ez mindegyiknek egyedi ujjlenyomatot ad, amely lehetővé teszi az elemek azonosításátjelent egy gáztartályban, vagy akár egy csillagban.
olyan eszközöket használhatunk, mint például az elemek periódusos táblázata, hogy pontosan kitaláljuk, hány proton van, így az elektronok, egy atom. Először is tudjuk, hogy ahhoz, hogy egy atom semleges töltéssel rendelkezzen, azonos számú protonnak és elektronnak kell lennie. Ha egy atom elveszíti vagy elnyeri az elektronokat, akkor válikionizált vagy feltöltött. A Periódusos táblázat megadja nekünk az atomi számotegy elem. Az atomszám azt mondja nekünk, hogy hány proton egy atomvan., Például a hidrogén atomszáma egy-ami azt jelenti, hogy van egy proton, tehát egy elektron -, és valójában nincs neutronja.
A hallgató számára
az atom korábbi leírása alapján rajzolja meg a hidrogénatom amodelt. Az atom” standard ” modellje ismertmint a Bohr modell.
ugyanazon kémiai elem különböző formáit, amelyek csak a magban lévő neutronok számától különböznek, izotópoknak nevezzük. A legtöbb elem rendelkeziktöbb mint egy természetben előforduló izotóp., Az atomreaktorokban és a tudományos laboratóriumokban több izotópot állítottak elő. Az izotópok általában nem nagyon stabilak, és általában radioaktív bomláson mennek keresztül, amíg nem alakul ki valami, ami stabilabb. Lehet, hogy ismeri az elementurániumot – több instabil izotópja van, az U-235 az egyik leginkábbcsak ismert. A 235 azt jelenti, hogy az urán ezen formája 235 neutronés protonok kombinálva. Ha megnéznénk az urán atomszámát, és 235 – től kiszámolnánk, hány neutron van az izotópban.,
itt van egy másik példa – a szén általában C-12 (szén-12), azaz 6 proton és 6 neutron formájában fordul elő, bár az egyik izotóp C-13, 6protonnal és 7 neutronnal.
A tanuló számára
használja a periódusos táblázatot és az alábbi elemek nevét, hogy megtudja, hány protonja, neutronja és elektronja van.Rajzoljon egy atommodellt a következő elemből: Szilícium-28,magnézium-24, kén-32, oxigén-16, hélium-4.,
A hallgató számára a szöveg használatával határozza meg a következő kifejezéseket: energiaszintek, abszorpció, emisszió, gerjesztett állapot, talajállapot, ionizáció, atom,elem, atomtömeg, atomszám, izotóp.
opcionális Megjegyzés Az atomok kvantummechanikai természetérőlmíg a fent leírt Bohr-atom jó módja annak, hogy megismerjük az atomok szerkezetét, ez nem a legpontosabb módszer., bár minden pályának pontos energiája van, az elektront most úgy képzelik el, hogy a magot körülvevő “elektronfelhőben”elkenődik. Gyakran beszélünk a thecloud átlagos távolságáról, mint az elektron sugara orbit.So ne feledjük, megtartjuk a “orbitális” és “orbitális” szavakat, bár nem egy lapos orbitális sík leírására használjuk őket, hanem arra, hogy egy elektron létezésének valószínűsége legyen. az elektronokat a mag és az elektronok közötti elektromos vonzás tartja a mag közelében.,Úgy tartják ott, ahogy a kilenc bolygó a Nap közelében marad, ahelyett, hogy a galaxist szétzúzná. Ellentétben a naprendszerrel, ahol az összes bolygó pályájaegy síkban vannak, az elektronok keringése háromdimenziós. Mindegyikaz atom energiaszintje eltérő alakú. Vannak matematikaeredmények, amelyek megmutatják az elektron elhelyezkedésének valószínűségét ezen a pályán. tekintsük aa hidrogénatom, amelyet már rajzoltunk egy Bohr modellt.,
Az ebben a részben szereplő szövegeket és képeket Dave Slaven oldaláról adaptálták (Lásd az alábbi hivatkozásokat). |

