Nucleophilic Helyettesítése a Hidroxil-Csoport
A kémiai viselkedését alkil-halogenidek lehet használni, mint egy referencia felfedezni hasonló helyettesítő, illetve eliminációs reakciók alkoholok. A fő különbség természetesen a halidról a hidroxidra való kilépő anion változása. Mivel az oxigén valamivel elektronegatívabb, mint a klór (3.5 vs. 2.8 A Pauling skálán), a C-O kötés várhatóan polárisabb lesz, mint a C-Cl kötés., Továbbá a független intézkedés a electrophilic jellemzők szén atomok a NMR kémiai műszakban (mindkét 13C alfa proton) azt jelzi, hogy az oxigén, a klór substituents gyakoroljon egy hasonló elektron-visszavonja hatása, amikor kötődik sp3 keresztez szénatommal. Ennek az ígéretes háttér-bizonyítéknak ellenére az alkoholok nem mennek keresztül ugyanazokon az SN2 reakciókon, amelyeket általában alkil-halogenidekkel figyeltek meg. Például az 1-brómbután nátrium-cianiddal történő gyors SN2 reakciója, az alábbiakban látható, nem párhuzamos, ha az 1-butanolt nátrium-cianiddal kezelik., Valójában az etil-alkoholt gyakran használják oldószerként az ilyen alkil-Halid szubsztitúciós reakciókhoz.
CH3CH2CH2CH2–Br + na(+) CN(–)  CH3CH2CH2CH2CH2–CN + Na(+) br(–)
CH3CH2CH2CH2CH2–CN + Na(+) br(–)
CH3CH2CH2CH2CH2CH2–Oh + Na(+) CN(–)  no reaction
no reaction
a legfontosabb tényező itt a kilépő anion stabilitása (bromid vs.hidroxid)., A HBr sokkal erősebb sav, mint a víz (több mint 18 nagyságrenddel), s ez a különbség tükröződik reakciók létre a megfelelő konjugált bázis. A gyengébb bázis, a bromid stabilabb, szubsztitúciós vagy eliminációs reakcióban való felszabadulása sokkal kedvezőbb, mint a hidroxidioné, amely erősebb és kevésbé stabil bázis.
egyértelmű lépés az alkoholok reaktivitásának javítása felé az SN2 reakciókban az –Oh funkcionális csoport módosítása oly módon, hogy javítsa stabilitását, mint kilépő anion., Az egyik ilyen módosítás az, hogy a szubsztitúciós reakciót erős savban végezzük, átalakítva –OH –OH2-ra(+). Mivel a hidrónium-ion (H3O (+)) sokkal erősebb sav, mint a víz, konjugált bázisa (H2O) jobb elhagyó csoport, mint a hidroxid-ion. Az egyetlen probléma ezzel a stratégiával az, hogy sok nukleofil, beleértve a cianidot is, erős savak protonálásával deaktiválják, hatékonyan eltávolítva a helyettesítéshez szükséges nukleofil Ko-reagenst., A HCl, HBr és HI erős savak nem tartoznak e nehézség alá, mivel konjugált bázisaik jó nukleofilek, és még gyengébb bázisok, mint az alkoholok. A következő egyenletek szemléltetik az alkoholok néhány szubsztitúciós reakcióját, amelyeket ezek a savak érinthetnek. Az alkil-halogenidekhez hasonlóan az 1º-alkoholok nukleofil szubsztitúciója SN2 mechanizmussal történik, míg a 3º-alkoholok SN1 mechanizmussal reagálnak. A 2º-os alkoholok reakciói mindkét mechanizmus által előfordulhatnak, és gyakran átrendezett termékeket termelnek., Az ásványi sav-képletek melletti zárójelben lévő számok egy koncentrált vizes oldat súlyszázalékát képviselik, amely formában ezeket a savakat általában használják.
bár ezeket a reakciókat néha” savkatalizáltnak ” nevezik, ez nem szigorúan helyes. A teljes transzformáció során erős HX savat alakítanak át vízbe, nagyon gyenge savat, így legalább sztöchiometrikus mennyiségű HX szükséges az alkohol alkil-haliddá történő teljes átalakításához., A nagyon erős savak egyenértékű mennyiségének alkalmazása ebben a reakcióban korlátozza hasznosságát a fent bemutatott típusú egyszerű alkoholokra. A savérzékeny csoportokkal rendelkező alkoholok természetesen nem tolerálják az ilyen kezelést. Ennek ellenére az a gondolat, hogy a-Oh funkcionális csoportot módosítsák annak stabilitásának javítása érdekében, mint kilépő anion, más irányba is folytatható. Az alábbi ábra néhány olyan módosítást mutat be, amelyek hatékonynak bizonyultak. A hidroxilcsoport minden esetben erős sav észterévé alakul. Az első két példa a korábban leírt szulfonát-észtereket mutatja., A harmadik és negyedik példák foszfitészter képződését mutatják (X a fennmaradó brómokat vagy további alkohol-szubsztituenseket jelenti), illetve kloroszulfit-észtert. Mindegyik elhagyó csoport (kék színű) konjugált savakkal rendelkezik, amelyek sokkal erősebbek, mint a víz (13-16 tíz erővel); így a kilépő anion ennek megfelelően stabilabb, mint a hidroxid-ion. A mezilát és a tozilát vegyületek különösen hasznosak, mivel számos nukleofil szubsztitúciós reakcióban alkalmazhatók., Az alkoholok foszfor-tribromiddal és tionil-kloriddal (utolsó két példa) történő reakcióiban előállított intermediereket ritkán izolálják, és ezek a reakciók továbbra is alkil-bromidot és kloridtermékeket termelnek.
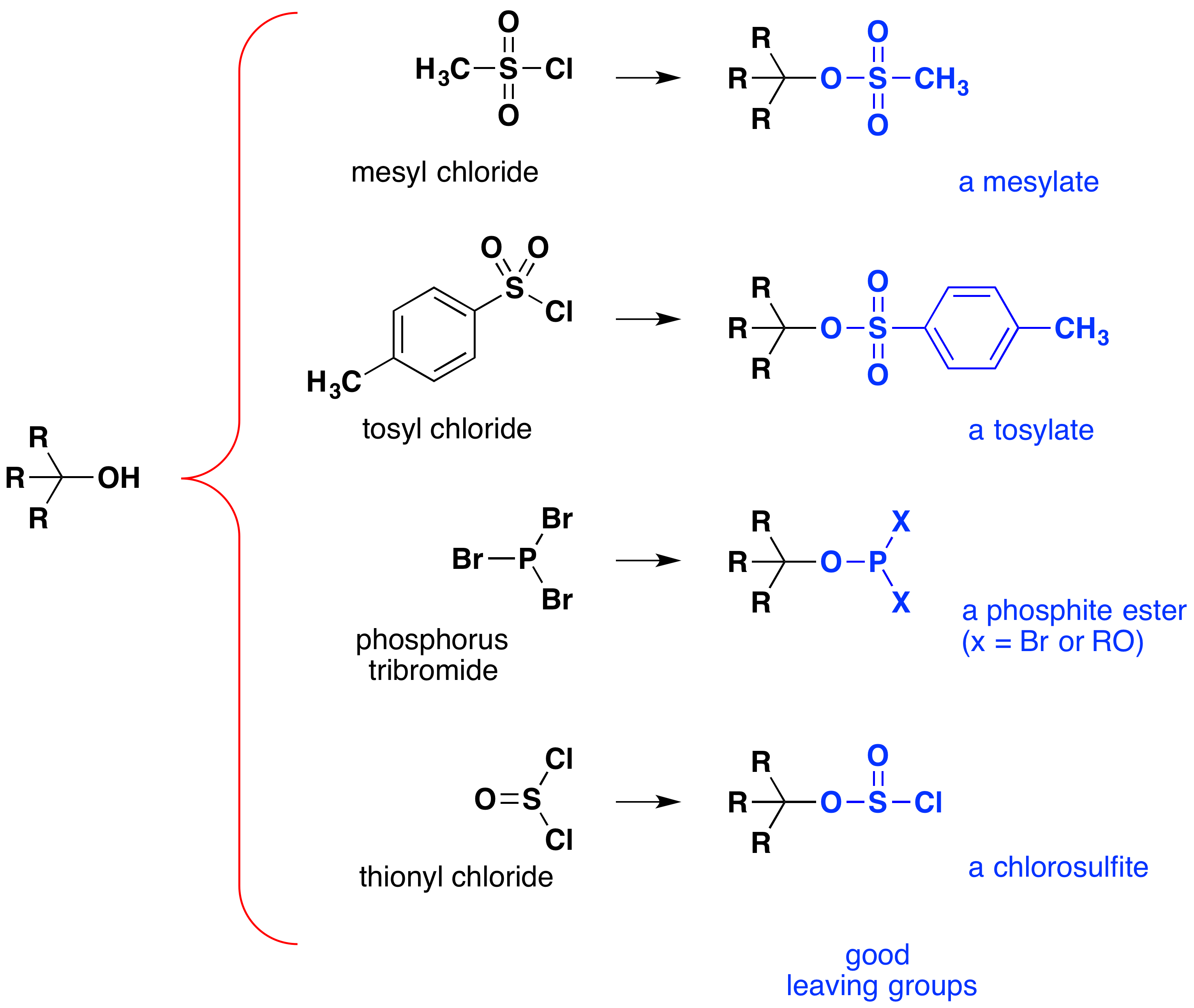
a szulfonát-észter-intermedierek jelentősége az alkoholok általános nukleofil szubsztitúciós reakcióiban az 1-butanol pentanenitrilné (butil-cianid) történő átalakításával szemléltethető, olyan reakció, amely önmagában az alkohollal nem fordul elő., A foszfor és a tionil-halidok viszont csak az alkoholok megfelelő alkil-halogenidekké történő átalakítására szolgálnak.,
| CH3CH2CH2CH2–OH + CH3SO2Cl | pyridine
|
CH3CH2CH2CH2–OSO2CH3 | Na(+) CN(–)
|
CH3CH2CH2CH2–CN + CH3SO2O(–) Na(+) |
Some examples of alcohol substitution reactions using this approach to activating the hydroxyl group are shown in the following diagram., Az első két eset megerősíti azt a tényt, hogy az alkoholok szulfonát-észter-származékai az alkil-halogenideket különböző SN2 reakciókban helyettesíthetik. A következő két eset bizonyítja a foszfor-tribromid használatát az alkoholok bromidokká történő átalakításában. Ez a reagens bázis hozzáadása nélkül is használható (pl. piridin), mivel a foszforsav termék gyengébb sav, mint a HBr. A foszfor-tribromidot leginkább 1º-alkoholokkal lehet használni, mivel a 2º-alkoholok gyakran átrendeződő melléktermékeket eredményeznek a Versengő SN1 reakciókból., Vegye figyelembe, hogy a 4.reakcióban lévő éter-oxigént ez a reagens nem befolyásolja, míg az alternatív szintézis koncentrált HBR-étereket használ. A foszfor-triklorid (PCl3) hasonló módon alakítja az alkoholokat alkil-kloridokká, de a tionil-kloridot általában előnyben részesítik ebben az átalakulásban, mivel a szervetlen termékek gázok (SO2 & HCl). A foszfor-triiodid nem stabil, de in situ formában előállítható vörös foszfor és jód keverékéből, és az alkoholokat alkil-jodidokká alakítja., Az utolsó példa a tionil-klorid reakcióját mutatja királis 2º-alkohollal. A szerves bázis, például a piridin jelenléte azért fontos, mert jelentős koncentrációjú klorid-iont biztosít, amely a kloroszufit közbülső végső SN2 reakciójához szükséges., Hiányában egy bázis, chlorosufites bomlanak fel fűtés hozam várható alkil-klorid megtartása konfigurációs
Tercier alkoholok nem általánosan használt szubsztitúciós reakciók a típus itt tárgyalt mert SN1, valamint E1 reakció utak domináns könnyű irányítani.

a szulfonát-észterek mint intermedierek fontosságát számos szubsztitúciós reakcióban nem lehet túlbecsülni., Az SN2 reakciók helyettesítési helyén fellépő konfigurációs inverzió szigorú bizonyítéka az ilyen reakciókat használja. Az alábbiakban egy példa található egy ilyen bizonyítékra. A leggyakrabban használt szulfonilszármazékok rövidítéseit a következő táblázat tartalmazza.
| CH3SO2– | ch3c6h4so2– | brc6h4so2– | cf3so2– | ||
| Name & abbrev., | Mesyl vagy Ms | Tosyl vagy Ts | Brosyl vagy B | Trifyl vagy Tf |
Inverzió Bizonyíték

A részletes vita hidroxil szubsztitúciós reakciók, illetve a leírás más szelektív módszereket ez az átalakulás, Kattintson Ide.
- William Reusch, Professor Emeritus (Michigan State U.,), Virtual Textbook of Organic Chemistry