Bevezető
a téli időszakban néha bőrgyógyász kap tünetmentes betegek, nem specifikus elváltozások más, mint, talán egy post-gyulladásos elszíneződés, de egy égető szüksége van a segítségedre. Az év első intenzív napsugárzása után elkezdik elmondani a bőrükön megjelenő papulák vagy hólyagok történetét., A sérülésekkel együtt szörnyű viszketés kezdődik és növekszik a betegség terjedésével, a következő napsugárzás után, amelyet néha egyfajta égő érzés súlyosbít. Ennek ellenére ezek az emberek modell nap keresők, és továbbra is élvezik a napsütést egész nyáron, várva, hogy a papulák fokozatosan elhalványuljanak és eltűnjenek. A fő kérdések a következők: Hogyan tudom megakadályozni ezt? Miért kapok ezt a problémát az ” 5 ” évek óta, de még soha nem volt ilyen?,
valószínűleg polimorf fénykitöréssel (PLE) foglalkozunk, és pácienseink kérésére az orvosi kutatások elsősorban a megelőzési stratégiákra összpontosítottak, amelyek manapság meglehetősen kielégítőek. A másik oldalon, a második, és természetesen kevésbé feltárt kérdés továbbra sem tisztázott, kivéve, ha több darabot adtak hozzá ehhez a meglehetősen bonyolult puzzle-hez. A rövid áttekintés célja a PLE lehetséges mechanizmusainak legfrissebb előrehaladásának folytatása, valamint a megelőzés vagy a kezelés leggyakrabban használt protokolljai.
polimorf Fénykitörés patofiziológiája: Mi újság?,
KÉR a leggyakoribb fényérzékeny zavar jellemzi időszakos kitörés nem hegesedés nyílásaiból erythemás papulák, hólyagok vagy plakkok (1. Ábra), hogy dolgozzon órán belül ultraibolya sugárzás (UVR) expozíció a beteg bőrre. A betegség a genetikai érzékenységtől, valamint a környezeti komponenstől, például az expozíció típusától függ. Úgy tűnik, hogy a PLE családokban halmozódik fel: becslések szerint a PLE prevalenciája 21, illetve 18% volt monozigotikus, illetve dizygotikus ikrekben (1)., Ezenkívül az első fokú rokonoknál a PLE pozitív családi anamnézise az érintett iker Párok 12% – ában volt jelen az érintetlen iker Párok 4% – ánál (p < 0.0001). A probandwise konkordancia monozygota jobb volt, mint a dizygotic iker pár (0.72 vs 0.30-kal), amelyek igazolják, erős genetikai hatás (1). A PLE patogenezisében potenciális érdeklődésre számot tartó géneket általában nem várt eredményekkel vizsgálták., A szegregáció elemzésével becslések szerint az Egyesült Királyság lakosságának 72% – A hordoz alacsony penetrációs PLE érzékenységi allélt (2).
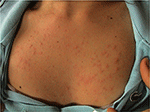
1.ábra. Klinikai kép polimorf fény kitörés egy fiatal nő.
az apoptózis kudarca: a lehetséges Foto-indukált Neo antigének
egy nemrégiben genomra kiterjedő expressziós elemzésben csak 16 gén különbözött egymástól a PLE és az egészséges kontrollok között az UV-besugárzás után a kontroll tekintetében (3)., E gének közül 14 alacsonyabb expressziót mutatott a PLE-ben szenvedő betegeknél, míg kettő túlzott expressziót eredményezett. A PLE-ben alacsonyabb expresszióval rendelkező 14 gén közül a következők tartoznak: KOMPLEMENT 1s alegység (C1s), scavenger receptor B1 (SCARB1) fibronektin (FN1), immunglobulin szupercsalád tagja 3 (IGSF3), kaszpáz-1 (CASP1) és paraoxonáz 2 (PON2), az apoptotikus sejt clearance-hez kapcsolódó összes gén. Feltételezték, hogy az apoptotikus sejt clearance során a fehérjemódosítás potenciális autoantigén képződéshez vezethet (4)., Ezután az ehhez a folyamathoz kapcsolódó gének PLE-ben szenvedő betegeinek csökkent expressziója egy lehetséges autoantigénforrást, valamint egy kritikus fázist jelenthet a betegséget elősegítő autoimmun folyamat megindításában (3). E megállapítások szerint Kuhn et al. megmutatta felhalmozási apoptotic sejtek KÉR betegek besugárzott vagy 1,5 Minimális Erythema Dózis (MED) az UVB, vagy 60-100 J/cm2 UVA1, a kontroll csoporthoz képest (5).,
Védettség: Tolerancia Hiba
Auto-antigének származó hatékony clearance apoptotic sejtek, valószínűleg veszik fel a dendritic cells (DCs), majd ismertette, hogy a naiv T-sejtek (citotoxikus pedig segítő), ezt követően átalakult auto-reaktív T sejtek (6, 7). Az apoptózis ezen részleges kudarca az UV-expozíció utáni elégtelen immunszuppresszióval együtt hozzájárul az antigén felismeréséhez és megjelenítéséhez, ami a PLE-re jellemző klinikai megnyilvánuláshoz vezet (8)., Valójában a normál UVR-indukált immunszuppresszió kudarcát a PLE fő immunológiai rendellenességeként bizonyították, amelyet kezdetben a Langerhans-sejtek (LCs) állandósága magyarázott az epidermiszben. Ez az immunrendszer túlzott aktiválása, amely a funkcionális UV-indukált tolerancia felé menekül, valószínűleg felelős a PLE-ben szenvedő betegek csökkent bőrrák prevalenciájáért (9). Másrészt ugyanaz a mechanizmus bűnös az allergiás kontakt dermatitisz (ACD) elnyomásának kudarcáért, az UVR expozíció után (10).,
gyulladásos út: késleltetett típusú túlérzékenységi reakció
a PLE-ben részt vevő immunológiai mechanizmusok, a veleszületett és adaptív immunrendszer mediátoraival, szövettani vagy biokémiai szempontból nagyon hasonlóak az ACD-hez. Valójában a hetvenes évek elején az Epstein először késleltetett típusú túlérzékenységi reakcióként (DTHR) jelezte a PLE-t a meghatározatlan UVR-indukált bőr antigénre (11). A közelmúltban ennek a koncepciónak a megerősítése érdekében az ACD-ben részt vevő gyulladásos mediátorok egy részét a PLE-ben is kimutatták., Például az IL-1 családot (12, 13), a citokinek növekvő csoportját, amely számos szerepet játszik az immunszabályozásban és a gyulladásban (14), szintén részt vesz az ACD patogenezisében (12, 15), a PLE-ben is felfedezték (16). Az IL-36α és az IL-36γ, az IL-1 család pro-gyulladásos tagjait PLE-ben növelték a kontrollok tekintetében, mint az ACD minták esetében, de az IL-36γ sokkal nagyobb volt a PLE-ben, mint az ACD-ben (16). Az IL-36R és IL-1R/AcP (IL-1RL2), IL-36α, IL-36β és IL-36γ közös receptoron keresztül ható NF-kB és MAPKs aktiválódik, elősegítve a gyulladásos reakciókat., A PLE-ben szenvedő betegek bőr-és perifériás vérében az IL-36S növekedése a helyi és szisztémás immunválasz aktiválódását jelzi, amint azt több gyulladásos bőrbetegség (15, 17, 18) is kimutatta. Valószínűleg az IL-36S és az UVR expozíció közötti kapcsolatot a toll like receptor (TLR)-3 aktiváció parakrin pro-gyulladásos jele képviseli, az RNS nekrotikus keratinociták általi felszabadulása miatt (19). Valójában az apoptotikus clearance meghibásodása a PLE-ben, rengeteg celluláris törmelékkel, felelős lehet ennek a “riasztási jelnek az erősítéséért.,”
ezenkívül az IL-36-ok hozzájárulhatnak a veleszületett immunjel és az ebből következő gyulladásos kaszkád erősítéséhez, elősegítve az antimikrobiális peptideket (erősítők) (20).
Gyulladásos Útvonal: Erősítő, valamint Microbiome
nagyrészt vizsgált több bőr gyulladásos folyamatok, ezek a közvetítők, a neve, mint defensins (α, illetve β), cathelicidin (LL37), ribonuclease 7 (RNase7), valamint psoriasin (S100A7), a fény, az egyensúly által kiváltott UVR a hámsejtek, valamint a bőr microbiome is vizsgálták a KÉR (21, 22). Patra et al., megállapították, hogy a psoriasin, az rnase7, a HBD-2 és az LL-37 expressziója emelkedett a PLE lesional bőrben, míg a HBD-3 csökkent. Figyelembe véve a bőrfelületet, mint “többnemzetiségű világot”, anélkül, hogy elfelejtenénk a keratinociták döntő szerepét, nem zárhatjuk ki, hogy az erősítők felszabadulását az UV-kölcsönhatás után a mikrobiómkomponensek módosításával lehet meghatározni (23). Valójában a mikrobióma a PLE-ben szenvedő betegeknél kialakult, még nem észlelt UVR-indukált antigének közvetlen vagy közvetett forrását jelentheti, ami keratinocita károsodáshoz vezet., Ennek következtében az UVB, IFNy, TNF-α, IL-6 által indukált LL-37 a PLE (23) potenciális közvetett meghajtóját jelentheti. Aggregátumokat képezhet önálló nukleinsavakkal, amelyek képesek aktiválni a PDC-ket: a psoriasisban a fő autoantigént (24) ismerik el. Annak ellenére, hogy a PLE-ben szenvedő betegeknél PDC-k teljes hiányát jelentették (25), autoimmun miliő létezik, és az LL-37 döntő szerepet játszhat, más gyulladásos utakat indukálva. Az S1 ábrán (Kiegészítő anyag) a fenti fogalmakat egy rajzfilmben ábrázolják.
polimorf Fénykitörés terápiája: Mi újság?,
a PLE-kezelés első vonala a napelkerülés, a fényvédő szerek és a lokális kortikoszteroidok (26). Minden beteg esetében a megelőző kezelés alapvető fontosságú a napsütéses időben, az intenzív UV-sugárzás elkerülése és a védőruházat használata, valamint a fényvédő alkalmazása révén, különösen az év első expozíciója során. Az UVB (SPF) magas napvédő faktorral rendelkező új generációs széles spektrumú fényvédőkről, valamint a hosszabb hullámhosszú UVA védelemről számoltak be, hogy a PLE-betegek legfeljebb 90% – ánál (27, 28) teljes vagy részleges védelmet nyújtanak., Az orális antioxidánsok és a nikotinamid alkalmazása további érvényes megelőző intézkedést jelenthet ezeknél a betegeknél. A nikotinamid jótékony hatásait egy 42 betegen végzett, nem kontrollált vizsgálatban vizsgálták, ahol 60% – uk számolt be a tünetek teljes megszüntetéséről, amikor napi 2-3 g nikotinamidot vett be napozás előtt (29). Ezenkívül kimutatták, hogy a trópusi páfrány Polipodiumleucotomos [PL) kivonata mind erős antioxidáns, mind immunmoduláló hatást fejt ki., A napi 480 mg-os adag alkalmazása a napozás előtt jelentősen csökkentette a bőrreakciókat és a szubjektív tüneteket (30, 31). A helyi kortikoszteroid tekintetében, még akkor is, ha nem végeztek vizsgálatokat a PLE-ben való hatékonyságuk meghatározására, széles körben alkalmazzák a viszketés csökkentésére (26). A PLE-kezelés második sora szisztémás kortikoszteroidokat és Foto(kemo)terápiát tartalmaz (26). Egy randomizált, kettős-vak, placebo-kontrollos vizsgálatban (32) A szerzők 25 mg prednizolon napi alkalmazását javasolták 4-5 napig a kitörés kezdetén., Bár figyelembe kell venni a prednizolon ismételt tanfolyamainak lehetséges hosszú távú mellékhatásait, tanácsos lehet olyan betegek számára, akik alkalmi PLE-támadásokban szenvednek, ellenjavallatok hiányában. Enyhébb esetekben a PLE, önkondicionáló program diplomás napfénynek való kitettség tavasszal elegendő lehet (33). Míg súlyosabb esetekben az orvosilag felügyelt kondicionáló / deszenzitizáló kezelés megfelelőbb lehet., A psoralen és UVA terápia (PUVA), a keskeny sávú (NB)-UVB vagy a szélessávú (BB)-UVB fototerápia, amelyet általában kora tavasszal adnak be, hatékony lehet, valamint profilaktikus kezelés (26). A kezelési protokoll általában 5-6 hét alatt egy fototerápiából/fotokémoterápiából áll. A kezdő dózisok a minimális erythemalis dózistól (med) vagy a minimális fototoxikus dózistól (MPD) függenek, és gyakran a mért küszöbértékek 50-70% – a növekményes emelkedéssel történik., A deszenzitizáló terápiával szerzett előny fenntartása érdekében a nyár folyamán rendszeres napozás javasolt, különben a keményedés 4-6 héten belül elveszhet. A PLE-kezelés során az NB-UVB-t előnyben kell részesíteni a PUVA-val szemben (a D ajánlás erőssége; a bizonyítékok szintje 4), mivel a fotokarcinogenezis kockázata alacsonyabb, nincs hányinger vagy egyéb mellékhatás a MOP lenyelésével kapcsolatban, és nincs szükség a kezelés utáni szemvédelemre. A PUVA-t azonban más szisztémás kezelések előtt meg kell fontolni, ha az NB-UVB nem sikerült, vagy korábban kiváltotta a kitörést., Az alábbiakban leírtak szerint a hatásosságot több fototerápiás kezelés (BB-UVB, NB-UVB és PUVA) esetében igazolták, és a kiütéses provokáció, erythema és viszketés idején a mellékhatások gyakoribbak voltak az UVB-vel, mint a PUVA-val (34). Amint azt a szakirodalomban összefoglaltuk, a PUVA hatékonysága 65-100% – os fotoprotekciós arányt eredményez (34)., Több összehasonlító vizsgálatot is végeztek, de a PUVA és az NB-UVB és placebo tabletták között végzett egyetlen randomizált, kontrollos vizsgálatból, hetente háromszor, 5 héten keresztül, nem alakult ki szignifikáns hatásbeli különbség, figyelembe véve a PLE vagy a kültéri aktivitás korlátozásának előfordulását (35). A 10 éves visszamenőleges felülvizsgálat, jelentette Man et al. (36) 170, közepesen súlyos vagy súlyos PLE-ben szenvedő beteg kapott PUVA-t és/vagy UVB-fototerápiát. A következő évben 8 beteg kapott PUVA-t, 128 NB-UVB-t, 5 BB-UVB-t és 29 beteget, akik nem reagáltak kielégítően az NB-UVB-re, PUVA-t., A PLE-epizódok súlyosságáról és gyakoriságáról az őszi vagy a következő tavaszi nyomon követési látogatásokon önértékelést végeztek. A PUVA-val kezelt betegek 88% – ánál és az UVB-t kapó betegek 89% – ánál jelentettek jó vagy mérsékelt javulást. Mind a PUVA-val, mind az NB-UVB-vel kezelt betegek közül a többség a PUVA-t részesítette előnyben. A másik 14-éves retrospektív tanulmány 79 kezelt betegek fényterápia (37), a hatékonyság mérése során a következő nyáron a kifejezés photoprotection teljes/részleges remisszió, 65% volt a PUVA, 82% – os BB-UVB, illetve 83% – os UVA egyedül., Ebben az esetben a PUVA-kezelést súlyosabb PLE-formákra fenntartották.
azok a mechanizmusok, amelyekkel a fototerápia fotoprotekciót indukál, nem teljesen ismertek.
az elmúlt években azonban számos előrelépést hajtottak végre. A fototerápia melaninizációjára és epidermális megvastagodására gyakorolt jól ismert hatások mellett az UV-indukált immunmoduláló és gyulladáscsökkentő tulajdonságok széles skálájáról is beszámolnak (38)., Mind az UVB illetve UVA moduláló adhéziós molekula kifejezést, majd rábírja oldható közvetítők, például egy-melanocita stimuláló hormon, az IL-10 (ami elnyomja a termelés az interferon-γ), valamint a prosztaglandin-E2, hogy fejtsétek ki gyulladáscsökkentő intézkedések, megakadályozza a T sejtek aktiválása, valamint az apoptózis a bőrt infiltráló T sejtek (34). Ezenkívül kimutatták, hogy a PLE-ben szenvedő betegeknél a profilaktikus UV fotohardening visszaállítja az UV-indukált LC migrációt az epidermiszről a bőrelszívó nyirokcsomókra: az UV-immunszuppresszió egyik legfontosabb sejtes eseménye (39)., Az LC által kiváltott toleranciát az immunszuppresszív citokin, például az IL-10 felszabadulása, valamint a szabályozó T-sejtek (Tregs) érésével és indukciójával (40) történő interferencia közvetíti. Ráadásul a közelmúltban érdekes összefüggésről számoltak be az LC, a Tregek és a D3-vitamin között. Valójában bebizonyosodott, hogy egy rövid távú, 1 hetes helyi előkezelés az 1,25-dihidroxivitamin d analóggal, kalcipotriollal, csökkentette a PLE tüneteit a későbbi kísérleti fotoprovokáció után (41)., Ezenkívül egy Murin-vizsgálatban 1,25-dihidroxivitamin D hasonló immunszuppresszív hatásokat mutatott, mint az UV (42). Egy másik érdekes zebrát is kiemeltek az LCs és a hízósejtek között. Az atópiában elismert szerepük mellett a dermális hízósejtek felelősek a bőr UVB által kiváltott gyulladás elleni védelméért is, elősegítve az UV immunszuppressziót (40). Humán vizsgálatok kimutatták, hogy az akut és krónikus UVR-expozíció után a dermális hízósejtek száma növekszik az IL-10 felszabadulásával együtt., Összességében ezek az adatok arra utalnak, hogy a hízósejtek potenciális szerepet játszanak a PLE-ben és a fotohardening mechanizmusában. Ennek megfelelően Wolf et al. először számoltak be arról, hogy a fotohardening jelentősen növeli a hízósejtek sűrűségét a PLE betegek papilláris dermisében (40). Összefoglalva, a fotohardening a PLE-ben működik a normál UV immunszuppresszív út helyreállításával, több sejttípus bevonásával. A PLE harmadik vonalbeli kezelése magában foglalja a szisztémás immunszuppresszív gyógyszerek, például azatioprin és ciklosporin alkalmazását., A szakirodalomban azonban csak a sikeresen kezelt betegek szórványos eseteiről számoltak be (43, 44). Ezenkívül hidroxiklorokint, omega-3 zsírsavakat és béta-karotint javasoltak kezelésként, de további kettős-vak, randomizált, kontrollált vizsgálatokra van szükség a klinikai hatékonyságuk értékeléséhez.
következtetések
mivel a PLE magas prevalenciája és növekvő előfordulási gyakorisága kellemetlen érzésekhez és életmódbeli korlátozásokhoz kapcsolódik, a jövőbeli vizsgálatokra új terápiás és/vagy megelőző stratégiák megtalálásához van szükség., A megfelelő PLE-kezelés kiválasztása megköveteli a betegség egyéni klinikai lefolyásának jó ismeretét, valamint a fototest elvégzésének lehetőségét. Kiemeltek néhány új szempontot a gyulladásos folyamat lehetséges aktiválásában és előmozdításában.,
a jelenlegi ismeretek szerint az immuntolerancia helyreállításával kapcsolatos néhány kulcsfontosságú sejtszabályozás azonosítása ellenére nehéz határozott következtetéseket levonni a PLE különböző lehetséges kezeléseinek hatékonyságáról, a megfelelő vizsgálatok hiánya és az eredménymérések értékelésének nehézsége miatt. A PLE súlyosságának értékelésére szolgáló klinikai pontszám (PLESI) (45) továbbra is olyan eszköz, amelyet alig használnak, és főként kutatási célokra korlátozódnak., A rendellenesség mögöttes patogenetikai mechanizmusainak mélyebb vizsgálata lehetővé teszi a célzottabb kezelési megközelítést.
szerzői hozzájárulások
SL vetítette a kéziratot, kiválasztotta a papír anyagát, megírta az eredeti tervezetet, és kijavította a kézirat következő tervezeteit. AR részt vett a kézirat írásában, új tartalmi és stíluselméleteket támogatva.,
összeférhetetlenségi nyilatkozat
a szerzők kijelentik, hogy a kutatást olyan kereskedelmi vagy pénzügyi kapcsolatok hiányában végezték, amelyek potenciális összeférhetetlenségnek tekinthetők.
Kiegészítő anyag
S1 ábra. A veleszületett és az adaptív immunrendszer kölcsönhatása az epidermisz apoptózis-elégtelenségének összefüggésében. (Zöld szimbólum) Psoriasin: bőséges expresszió a PLE bőr spinózus és szemcsés rétegeiben. (Kék jel) RNase7: főként a stratum granulosum és a stratum corneum PLE léziók keratinocitáiban kifejezve., (Sárga jel) az LL-37 mélyen kifejeződött az erekben és a mirigyekben a PLE-ben. Apoptotikus keratinociták nem hatékony clearance-szel.,hic light eruption; ACD, Allergic contact dermatitis; DTHR, Delayed type hypersensitivity reaction; UVR, Ultraviolet radiation; C1s, Complement 1s subunit; SCARB1, Scavenger receptor B1; FN1, Fibronectin; IGSF3, Immunoglobulin superfamily member 3; CASP1, Caspase-1; PON2, Paraoxonase 2; MED, Minimal Erythema Dose; DCs, Dendritic cells; LCs, Langerhans cells; TLR, Toll like receptor; AMPs, Antimicrobial peptides; SPF, Sun protection factor; PUVA, Psoralen and UVA therapy; NB-UVB, Narrowband; BB-UVB, Broadband UVB; MPD, Minimum phototoxic dose; Tregs, Regulatory T cells; PL, Polypodiumleucotomos.,
2. McGregor JM, Grabczynska S, Vaughan R, Hawk JL, Lewis CM. Genetic modelling of abnormal photosensitivity in families with polymorphic light eruption and actinic prurigo. J Invest Dermatol. (2000) 115:471–6. doi: 10.1046/j.1523-1747.2000.00080.x
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Lembo S, Hawk JLM, Murphy GM, Kaneko K, Young AR, McGregor JM, et al., Aberrant gene expression with deficient apoptotic keratinocyte clearance may predispose to polymorphic light eruption. Br J Dermatol. (2017) 177:1450–3. doi: 10.1111/bjd.15200
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Savill J, Fadok V. Corpse clearance defines the meaning of cell death. Nature (2000) 407:784–8. doi: 10.,1038/35037722
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Kuhn A, Herrmann M, Kleber S, Beckmann-Welle M, Fehsel K, Martin-Villalba A, et al. Accumulation of apoptotic cells in the epidermis of patients with cutaneous lupus erythematosus after ultraviolet irradiation. Arthritis Rheum. (2006) 54:939–50. doi: 10.1002/art.21658
PubMed Abstract | CrossRef Full Text | Google Scholar
6., Savill J, Dransfield I, Gregory C, Haslett C. A blast from the past: clearance of apoptotic cells regulates immune responses. Nat RevImmunol. (2002) 2:965–75. doi: 10.1038/nri957
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Albert ML, Sauter B, Bhardwaj N. Dendritic cells acquire antigen from apoptotic cells and induce class I-restricted CTLs. Nature (1998) 392:86–9. doi: 10.,1038/32183
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Koulu LM, Laihia JK, Peltoniemi HH, Jansén CT. UV-induced tolerance to a contact allergen is impaired in polymorphic light eruption. J Invest Dermatol. (2010) 130:2578–82. doi: 10.1038/jid.2010.181
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Epstein JH. Polymorphous light eruption. J Am Acad Dermatol. (1980) 3:329–43.,
PubMed Abstract | Google Scholar
12. Mattii M, Ayala F, Balato N, Filotico R, Lembo S, Schiattarella M, et al. The balance between pro- and anti-inflammatory cytokines is crucial in human allergic contact dermatitis pathogenesis: the role of IL-1 family members. Exp Dermatol. (2013) 22:813–9. doi: 10.1111/exd.12272
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Dinarello CA., Interleukin – 1 a gyulladásos betegségek patogenezisében és kezelésében. Vér (2011) 117:3720-32. doi: 10.1182 / vér-2010-07-273417
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Lembo S, Caiazzo G, Balato N, Monfrecola G, Patra V, Farkas P, et al. Polimorf fénykitörés és IL-1 családtagok: van-e különbség az allergiás kontakt dermatitisben? Photochem Photobiol Sci. (2017) 16:1471–9. doi: 10.,1039/c7pp00142h
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Balato A, Schiattarella M, Lembo S, Mattii M, Prevete N, Balato N, et al. Interleukin-1 family members are enhanced in psoriasis and suppressed by vitamin D and retinoic acid. Arch Dermatol Res. (2013) 305:255–62. doi: 10.1007/s00403-013-1327-8
PubMed Abstract | CrossRef Full Text | Google Scholar
19., Borkowski AW, Kuo IH, Bernard JJ, Josida T, Williams Úr, Hung NJ. Útdíj-szerű receptor 3 aktiválás szükséges a normál bőr barrier javítás után UV károsodás. J. Invest Dermatol. (2015) 135:569–78. doi: 10.1038 / jid.2014.354
PubMed Abstract | CrossRef teljes szöveg | Google Scholar
20. Li N, Yamasaki K, Saito R, Fukushi-Takahashi S, Shimada-Omori R, Asano M, et al. A katelicidin antimikrobiális peptid ll37 Alarmin funkciója IL-36γ indukcióval humán epidermális keratinocitákban. J Immunol., (2014) 193:5140–8. doi: 10.4049/jimmunol.1302574
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Patra V, Wolf P. Microbial elements as the initial triggers in the pathogenesis of polymorphic light eruption? Exp Dermatol. (2016) 25:999–1001. doi: 10.1111/exd.13162
PubMed Abstract | CrossRef Full Text | Google Scholar
22., Gläser R, Navid F, Schuller W, Jantschitsch C, Harder J, Schröder JM, et al. Az UV-B sugárzás indukálja az antimikrobiális peptidek expresszióját humán keratinocitákban in vitro és in vivo. J Allergia Clin Immunol. (2009) 123:1117–23. doi: 10.1016 / j.jaci.2009.01.043
PubMed Abstract | CrossRef teljes szöveg | Google Scholar
23. Pátra V., Mayer G., Gruber-Wackernagel A., Kürt M., Lembo S., Farkas P., Egyedi profilja antimikrobiális peptid expresszió polimorf fény kitörés elváltozások képest egészséges bőr, atópiás dermatitis, psoriasis. Photodermatol Photoimmunol Photomed. (2018) 34:137–44. doi: 10.1111 / phpp.12355
PubMed Abstract | CrossRef teljes szöveg | Google Scholar
25. Schweintzger NA, Gruber-Wackernagel A, Shirsath N, Quehenberger F, Obermayer-Pietsch B, Wolf P. az évszakok hatása a D-vitamin szintekre és a szabályozó T-sejtekre polimorf fénykitörésben szenvedő betegeknél., Photochem Photobiol Sci. (2016) 15:440–6. doi: 10.1039/c5pp00398a
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Proby C, Baker C, Morton O, Hawk JLM. New broad spectrum sunscreen for polymorphic light eruption. Lancet (1993) 341:1347–8.
PubMed Abstract | Google Scholar
28. Allas S, Lui H, Moyal D, Bissonnette R., A 2 fényvédő képességének összehasonlítása az UV-A/UV-B fémhalogenid lámpa által kiváltott polimorf fénykitörés elleni védelemre. Arch Dermatol. (1999) 135:1421–2.
PubMed Abstract | Google Scholar
29. Ortel B, Wechdorn D, Tanew A, Honigsmann H. a nikotinamid hatása a fototest reakcióra polimorf fényben. BRJ Dermatol. (1988) 118:669–73.
PubMed Abstract | Google Scholar
30., Caccialanza M, Percivalle S, Piccinno R, Brambilla R. Photoprotective activity of oral Polypodiumleucotomos extract in 25 patients with idiopathic photodermatoses. Photodermatol Photoimmunol Photomed. (2007) 23:46–7. doi: 10.1111/j.1600-0781.2007.00274.x
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Tanew A, Radakovic S, Gonzalez S, Venturini M, Calzavara-Pinton P. Oral administration of a hydrophilic extract of Polypodiumleucotomos for the prevention of polymorphic light eruption., J Am Acad Dermatol. (2012) 66:58–62. doi: 10.1016/j.jaad.2010.09.773
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Van Praag MCG Boom, BW, Vermeer BJ. Diagnosis and treatment of polymorphous light eruption. Int J Dermatol. (1994) 33:233–9.
Google Scholar
34. Ling TC, Clayton TH, Crawley J, Exton LS, Goulden V, Ibbotson S, et al., British association of dermatologists and british photodermatology Group guidelines for the safe and effective use of psoralen-ultraibolya a therapy 2015. BRJ Dermatol. (2016) 174:24–55. doi: 10.1111 / bjd.14317
PubMed Abstract | CrossRef teljes szöveg | Google Scholar
36. Man I, Dawe RS, Ferguson J. mesterséges keményedés polimorf fény kitörés: gyakorlati pontok tíz éves tapasztalat. Photodermatol Photoimmunol Photomed. (1999) 15:3–4.,
PubMed Abstract | Google Scholar
37. Mastalier U, Kerl H, Wolf P. Clinical laboratory, phototest and phototherapy findings in polymorphic light eruptions: a retrospective study of 133 patients. Eur J Dermatol. (1998) 8:554–9.
PubMed Abstract | Google Scholar
38. Krutmann J, Morita A. Mechanisms of ultraviolet (UV) B and UVA phototherapy. J Invest Dermatol Symp Proc. (1999) 4:70–2.,
PubMed Abstract | Google Scholar
39. Janssens AS, Pavel S, Out-Luiting JJ, Willemze R, de Gruijl FR. Normalized ultraviolet (UV) induction of Langerhans cell depletion and neutrophil infiltrates after artificial UVB hardening of patients with polymorphic light eruption. Br J Dermatol. (2005) 152:1268–74. doi: 10.1111/j.1365-2133.2005.06690.x
PubMed Abstract | CrossRef Full Text | Google Scholar
40., Farkas P., Gruber-Wackernagel A., Bambach I., Schmidbauer U., Mayer G., Absenger M., ill. Fotohardening polimorf fény kitörés betegek csökkenti kiindulási epidermális Langerhans sejtsűrűség miközben növeli hízósejtek számát a papilláris dermis. Exp Dermatol. (2014) 23:428–30. doi: 10.1111 / exd.12427
PubMed Abstract | CrossRef teljes szöveg | Google Scholar
42. Schwarz A, Navid F, Sparwasser T, Clausen BE, Schwarz T., 1,25-dihydroxyvitamin D exerts similar immunosuppressive effects as UVR but is dispensable for local UVR-induced immunosuppression. J Invest Dermatol. (2012) 132, 2762–9. doi: 10.1038/jid.2012.238
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Norris PG, Hawk JL. Successful treatment of severe polymorphous light eruption with azathioprine. Arch Dermatol. (1989) 125:1377–9.
PubMed Abstract | Google Scholar