A Haber-folyamat rövid összefoglalása
A Haber-folyamat a levegőből származó nitrogént főként földgázból (metánból) származó hidrogénnel ötvözi ammóniává. A reakció reverzibilis, az ammónia termelése exoterm., ![]()
![]()
áramlási rendszer a Haber Folyamat így néz ki:
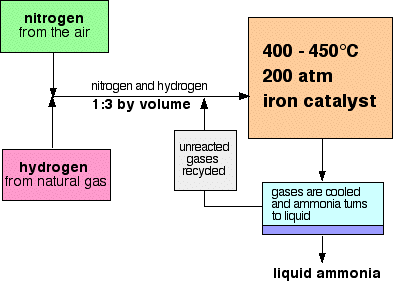
Néhány megjegyzés a feltételek
A katalizátor
A katalizátor valójában kissé bonyolultabb, mint a tiszta vas. Kálium-hidroxidot ad hozzá promóterként – olyan anyag, amely növeli annak hatékonyságát.
a nyomás
a nyomás gyártóüzemenként változik, de mindig magas. Egy 200 atmoszférát idéző vizsgán nem lehet messzire menni.,
újrahasznosítás
a reaktoron áthaladó gázok mindegyikénél a nitrogén és a hidrogén mindössze 15% – a ammóniává alakul át. (Ez a szám növényenként is változik.) A nem reagáló nitrogén és hidrogén folyamatos újrahasznosításával a teljes konverzió körülbelül 98%.
a nitrogén és a hidrogén arányainak magyarázata
a reaktorba kerülő nitrogén és hidrogén keveréke 1 térfogatú nitrogén és 3 térfogatú hidrogén arányában van.,
az Avogadro törvénye szerint azonos hőmérsékleten és nyomáson azonos mennyiségű gáz egyenlő számú molekulát tartalmaz. Ez azt jelenti, hogy a gázok a reaktorba kerülnek 1 molekula nitrogén és 3 hidrogén arányában.
Ez az egyenlet által igényelt Arány.
egyes reakciókban dönthet úgy, hogy az egyik reagens feleslegét használja. Ezt akkor tenné, ha különösen fontos, hogy a lehető legnagyobb mértékben felhasználja a másik reagenst – ha például sokkal drágább volt. Ez ebben az esetben nem érvényes.,
mindig van egy lefelé irányuló használata semmit más, mint az egyenlet arányait. Ha egy reaktáns feleslegben van, akkor olyan molekulák fognak áthaladni a reaktoron, amelyek nem tudnak reagálni, mert nincs semmi, amivel reagálhatnának. Ez hulladékok reaktor tér-különösen helyet a felszínen a katalizátor.
a hőmérséklet
egyensúlyi megfontolások
az egyensúlyi helyzetet a lehető legnagyobb mértékben jobbra kell tolni annak érdekében, hogy az egyensúlyi keverékben a lehető legnagyobb mennyiségű ammónia keletkezzen.,
az előre adott reakció (ammónia előállítása) exoterm.
![]()
![]()
a Le Chatelier elve szerint ez előnyben részesül, ha csökkenti a hőmérsékletet. A rendszer úgy reagál, hogy mozgatja az egyensúlyi helyzetet, hogy ellensúlyozza ezt – más szóval több hő előállításával.
annak érdekében, hogy az egyensúlyi keverékben a lehető legtöbb ammóniát kapja, a lehető legalacsonyabb hőmérsékletre van szüksége. A 400-450°C azonban nem alacsony hőmérséklet!,
Rate megfontolások
minél alacsonyabb a használt hőmérséklet,annál lassabb a reakció. A gyártó igyekszik a lehető legtöbb ammóniát előállítani naponta. Nincs értelme megpróbálni olyan egyensúlyi keveréket elérni, amely nagyon nagy mennyiségű ammóniát tartalmaz, ha több évig tart, amíg a reakció eléri ezt az egyensúlyt.
a gázoknak nagyon rövid időn belül el kell érniük az egyensúlyt, hogy érintkezésbe kerüljenek a reaktor katalizátorával.,
a kompromisszum
400-450°C kompromisszumos hőmérséklet, amely az egyensúlyi keverékben meglehetősen magas ammónia-arányt eredményez (még akkor is, ha csak 15%), de nagyon rövid idő alatt.
a nyomás
egyensúlyi megfontolások
![]()
![]()
vegye figyelembe, hogy az egyenlet bal oldalán 4 molekula található, de a jobb oldalon csak 2.,
A Le Chatelier elve szerint, ha növeli a nyomást, a rendszer úgy reagál, hogy előnyben részesíti a kevesebb molekulát termelő reakciót. Ez a nyomás újra csökken.
annak érdekében, hogy az egyensúlyi keverékben a lehető legtöbb ammóniát kapja, a lehető legnagyobb nyomásra van szüksége. A 200 atmoszféra nagy nyomás, de nem elképesztően magas.
Rate megfontolások
a nyomás növelése közelebb hozza a molekulákat egymáshoz., Ebben a konkrét esetben növeli annak esélyét, hogy a katalizátor felületére ütközzenek és tapadjanak, ahol reagálhatnak. Minél nagyobb a nyomás, annál jobb a gázreakció sebessége.
gazdasági megfontolások
nagyon nagy nyomás nagyon drága, hogy készítsen két számít.
rendkívül erős csöveket és tárolóedényeket kell építeni, hogy ellenálljanak a nagyon nagy nyomásnak. Ez növeli a tőkeköltségeket, amikor az üzem épül.
a magas nyomásnak sokba kerül a termelés és a fenntartás., Ez azt jelenti, hogy üzemének működési költségei nagyon magasak.
a kompromisszum
200 atmoszféra gazdasági alapon választott kompromisszumos nyomás. Ha az alkalmazott nyomás túl magas, akkor az előállítás költsége meghaladja az előállított extra ammónia árát.
a katalizátor
egyensúlyi megfontolások
a katalizátornak nincs semmilyen hatása az egyensúly helyzetére. A katalizátor hozzáadása nem eredményez nagyobb mennyiségű ammóniát az egyensúlyi keverékben. Az egyetlen funkciója a reakció felgyorsítása.,
Rate megfontolások
katalizátor hiányában a reakció olyan lassú, hogy gyakorlatilag egyetlen reakció sem történik ésszerű időben. A katalizátor biztosítja, hogy a reakció elég gyors ahhoz, hogy a dinamikus egyensúly nagyon rövid időn belül létrejöjjön, amikor a gázok valójában a reaktorban vannak.
Az ammónia elválasztása
amikor a gázok elhagyják a reaktort, azok forróak és nagyon nagy nyomáson vannak., Az ammónia könnyen cseppfolyósítható nyomás alatt, amíg nem túl forró, így a keverék hőmérséklete elég lecsökken ahhoz, hogy az ammónia folyadékká váljon. A nitrogén és a hidrogén még ilyen nagy nyomáson is gázként marad, és újrahasznosítható.
kérdések a megértés teszteléséhez
Ha ez az első kérdés, amit tettél, kérjük, olvassa el a bevezető oldalt, mielőtt elkezdené. A böngésző Vissza gombját kell használnia, hogy utána visszatérjen ide.,
kérdések A Haber folyamatról
válaszok
hová szeretne most menni?
az egyensúlyi menübe . . .
a fizikai kémia menübe . . .
a főmenübe . . .