tanulási célok
- ismeri az ionos és molekuláris anyagok fizikai tulajdonságait.
egy adott vegyület fizikai állapota és tulajdonságai nagymértékben függnek az általa megjelenített kémiai kötés típusától., A molekuláris vegyületek, amelyeket néha 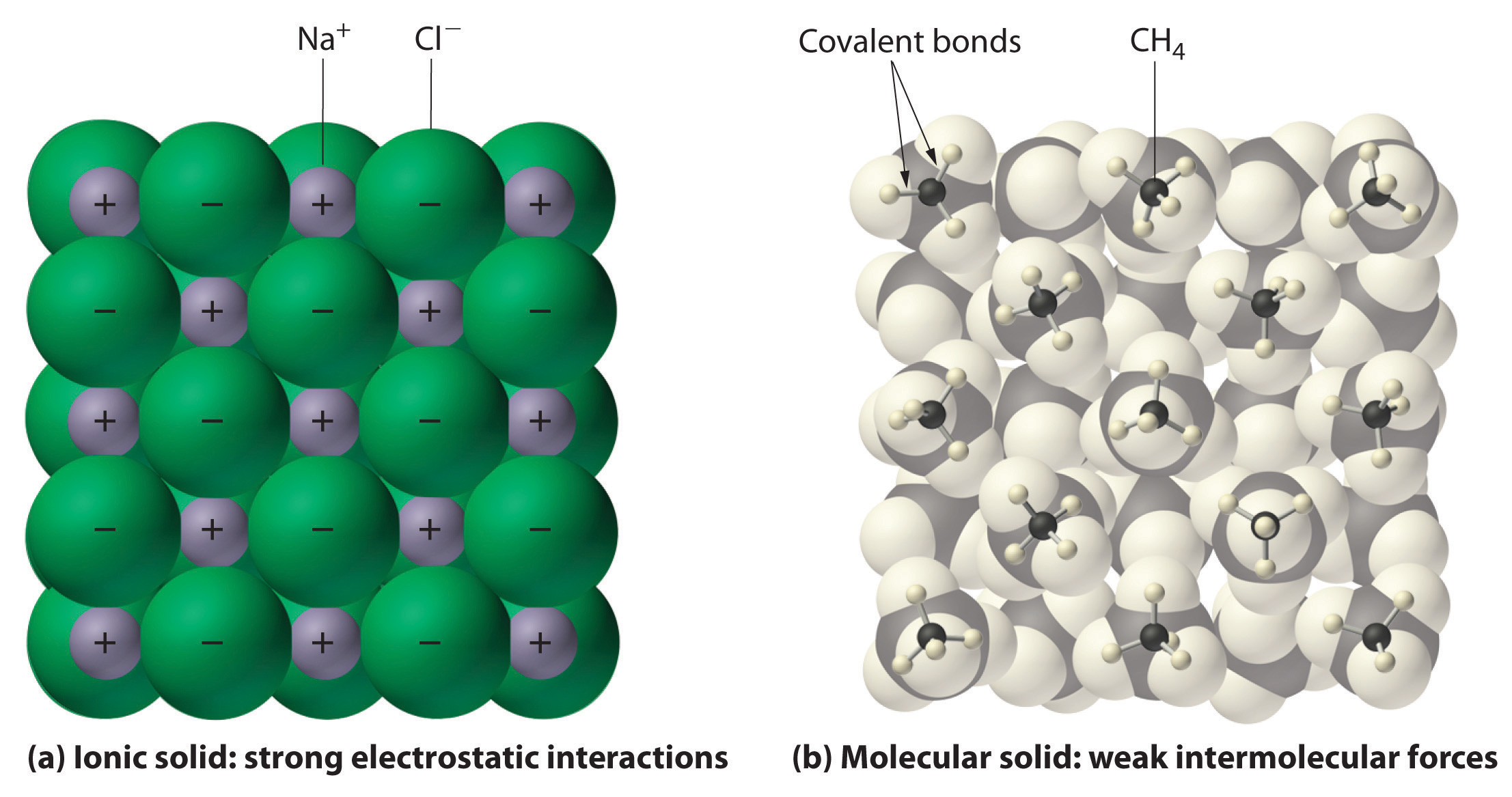 kovalens vegyületeknek neveznek, a fizikai tulajdonságok széles skáláját mutatják az intermolekuláris látnivalók különböző típusai, például a különböző poláris kölcsönhatások miatt. A molekuláris vegyületek olvadáspontja és forráspontja általában meglehetősen alacsony az ionos vegyületekéhez képest. Ennek oka az, hogy a molekulák közötti intermolekuláris erők megzavarásához szükséges energia sokkal kisebb, mint a kristályos ionos vegyület Ionos kötéseinek megszakításához szükséges energia (\(\PageIndex{1}\))., Az ionos szilárd anyagok jellemzően magas hőmérsékleten olvadnak, és még magasabb hőmérsékleten forrnak. Például a nátrium-klorid 801 °C-on olvad és 1413 °C-on forr. (összehasonlításképpen, a molekuláris vegyület víz 0 °C-on olvad és 100 °C-on forr.) A molekuláris vegyületek vízben való oldhatósága változó, és elsősorban az intermolekuláris erők típusától függ.
kovalens vegyületeknek neveznek, a fizikai tulajdonságok széles skáláját mutatják az intermolekuláris látnivalók különböző típusai, például a különböző poláris kölcsönhatások miatt. A molekuláris vegyületek olvadáspontja és forráspontja általában meglehetősen alacsony az ionos vegyületekéhez képest. Ennek oka az, hogy a molekulák közötti intermolekuláris erők megzavarásához szükséges energia sokkal kisebb, mint a kristályos ionos vegyület Ionos kötéseinek megszakításához szükséges energia (\(\PageIndex{1}\))., Az ionos szilárd anyagok jellemzően magas hőmérsékleten olvadnak, és még magasabb hőmérsékleten forrnak. Például a nátrium-klorid 801 °C-on olvad és 1413 °C-on forr. (összehasonlításképpen, a molekuláris vegyület víz 0 °C-on olvad és 100 °C-on forr.) A molekuláris vegyületek vízben való oldhatósága változó, és elsősorban az intermolekuláris erők típusától függ.
ábra \ (\PageIndex{1}\) kölcsönhatások Ionos és kovalens szilárd anyagokban.,
(a) a pozitív és negatív töltésű ionokat egy ionos szilárd anyagban, például
nátrium-klorid (NaCl) erős elektrosztatikus kölcsönhatások tartják össze.
(b) ebben A képviseletet, a csomagolás, a metán (CH4) molekulák szilárd metán,
a prototypical molekuláris szilárd, a metán molekula együtt tartják
a szilárd csak a viszonylag gyenge intermolecular erők, annak ellenére,
az atomok belül minden metán molekula tartják össze az erős kovalens kötés.,
mivel a molekuláris vegyületek semleges molekulákból állnak, elektromos vezetőképességük általában meglehetősen gyenge, akár szilárd, akár folyékony állapotban. Szilárd formában az ionos vegyület nem elektromosan vezetőképes, mert ionjai nem képesek áramlani (a” villamos energia ” a töltött részecskék áramlása). Olvadáskor azonban villamos energiát képes vezetni, mivel ionjai szabadon mozoghatnak a folyadékon keresztül (\(\PageIndex{2}\); Video \ (\PageIndex{1}\)).,

ábra \(\PageIndex{2}\) a nátrium-klorid 801 °C-on megolvad, és olvadáskor áramot vezet. (hitel: Mark Blaser és Matt Evans munkájának módosítása)
az olvadt só vezetőképessége
videó \(\PageIndex{1}\) Nézze meg ezt a videót, hogy a sók keveréke megolvadjon és áramot vezessen.
az alábbi táblázat összefoglalja az ionos és molekuláris vegyületek közötti különbségeket.,>
Vízben való oldhatóság
az Egyik típusú molekuláris összetett úgy viselkedik, egészen másképp, mint hogy leírt eddig., A kovalens hálózati szilárd olyan vegyület, amelyben az összes atom kovalens kötésekkel kapcsolódik egymáshoz. A gyémánt teljes egészében szénatomokból áll, amelyek mindegyike négy másik szénatomhoz kapcsolódik tetraéderes geometriában. A kovalens hálózati szilárdság megolvasztása nem érhető el a viszonylag gyenge intermolekuláris erők leküzdésével. Inkább az összes kovalens kötést meg kell szakítani, ami rendkívül magas hőmérsékletet igényel. A gyémánt valójában egyáltalán nem olvad. Ehelyett elpárolog a gáz feletti hőmérsékleten \(3500^ \ text{o} \ text{C}\).,
összefoglaló
- egy anyag fizikai tulajdonságait befolyásolják a molekulákat összetartó intermolekuláris erők.
- Az ionos vegyületek általában kemény kristályos szilárd anyagokat képeznek, magas olvadáspontokkal. A kovalens molekuláris vegyületek ezzel szemben gyenge intermolekuláris erők által összetartott diszkrét molekulákból állnak, amelyek szobahőmérsékleten és nyomáson gázok, folyadékok vagy szilárd anyagok lehetnek.
- ionos vegyületek olvadt formában vagy oldatban képesek villamos energiát vezetni, míg a molekuláris vegyületek nem..,
közreműködők
-
Marisa Alviar-Agnew (Sacramento City College)
-
Paul Flowers (University of North Carolina – Pembroke), Klaus Theopold (University of Delaware) és Richard Langley (Stephen F. Austin State University) közreműködő szerzőkkel. Tankönyv tartalom által termelt OpenStax College licenc alatt Creative Commons Attribution License 4.0 licenc. Letöltés ingyen itt: http://cnx.org/contents/85abf193-2bd…[email protected]).,
CK-12 Alapítvány: Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson és Jean Dupon.