Einführung
Im Winter erhalten Dermatologen manchmal asymptomatische Patienten ohne spezifische Läsionen außer vielleicht einer postinflammatorischen Verfärbung, aber mit einem verzweifelten Bedürfnis nach Hilfe. Sie beginnen, die Geschichte einer Reihe von Papeln oder Vesikeln zu erzählen, die nach der ersten intensiven Sonneneinstrahlung des Jahres auf ihrer Haut erscheinen., Zusammen mit den Läsionen beginnt und nimmt mit der Ausbreitung der Krankheit nach der nächsten Sonneneinstrahlung ein schrecklicher Juckreiz zu, der manchmal durch eine Art brennendes Gefühl verstärkt wird. Trotzdem sind diese Menschen vorbildliche Sonnensuchende und genießen den ganzen Sommer über die Sonne und warten darauf, dass die Papeln allmählich verblassen und verschwinden. Die Hauptfragen sind: Wie kann ich das verhindern? Warum bekomme ich dieses Problem seit “ 5 “ Jahren, aber ich hatte es noch nie zuvor?,
Wir haben es höchstwahrscheinlich mit polymorphem Lichtausbruch (PLE) zu tun, und nach den Wünschen unserer Patienten hat sich die medizinische Forschung hauptsächlich auf Präventionsstrategien konzentriert, die heutzutage recht zufriedenstellend sind. Auf der anderen Seite bleibt die zweite und sicherlich weniger erforschte Frage unklar, es sei denn, es wurden mehrere Teile zu diesem ziemlich komplizierten Puzzle hinzugefügt. Ziel dieser kurzen Überprüfung ist es, die neuesten Fortschritte in PLE möglichen Mechanismen und die am häufigsten verwendeten Protokolle für die Prävention oder Behandlung wieder aufzunehmen.
Pathophisiologie des polymorphen Lichtausbruchs: Was ist neu?,
PLE ist die häufigste lichtempfindliche Erkrankung, die durch einen intermittierenden Ausbruch von nicht vernarbenden juckenden erythematösen Papeln, Vesikeln oder Plaques gekennzeichnet ist (Abbildung 1), die sich innerhalb von Stunden nach ultravioletter Strahlung (UVR) entwickeln Exposition der Haut des Patienten. Die Krankheit ist abhängig von der genetischen Anfälligkeit, sowie Umweltkomponente, wie Art der Exposition. PLE scheint sich in Familien zu häufen: Es wurde geschätzt, dass die Prävalenz von PLE bei eineiigen bzw. zweieiigen Zwillingen 21 bzw., Darüber hinaus war eine positive Familienanamnese von PLE bei Verwandten ersten Grades bei 12% der betroffenen Zwillingspaare im Vergleich zu 4% der nicht betroffenen Zwillingspaare vorhanden (p < 0.0001). Die probandweise Konkordanz bei Monozygoten war überlegen als bei dizygoten Zwillingspaaren (0,72 vs. 0,30), was eine starke genetische Wirkung zeigte (1). Viele Gene von potenziellem Interesse an der Pathogenese von PLE wurden mit im Allgemeinen unwichtigen Ergebnissen untersucht., Anhand der Segregationsanalyse wurde geschätzt, dass 72% der britischen Bevölkerung ein Allel mit geringer Penetranz-PLE-Anfälligkeit tragen (2).
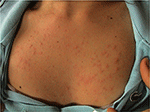
Abbildung 1. Klinisches Bild des polymorphen Lichtausbruchs bei einer jungen Frau.
Das Versagen der Apoptose: die Möglichen Foto-Induced Neo-Antigene
In a recent genome-wide expression analysis, nur 16 differentiell exprimierten Gene wurden zwischen PLE und gesunden Kontrollen nach UV-Bestrahlung hinsichtlich control (3)., Von diesen Genen zeigten 14 eine geringere Expression bei PLE-Patienten, während zwei überexprimiert wurden. Zu den 14 Genen mit geringerer Expression in PLE gehören: Komplement-1s-Untereinheit (C1s), Schnitzelrezeptor B1 (SCARB1) Fibronektin (FN1), Immunglobulin-Superfamilienmitglied 3 (IGSF3), Caspase-1 (CASP1) und Paraoxonase 2 (PON2), alle Gene, die mit der apoptotischen Zellclearance assoziiert sind. Es wurde angenommen, dass eine Proteinmodifikation während der apoptotischen Zellclearance zu einer potenziellen Autoantigen Bildung führen könnte (4)., Dann könnte die reduzierte Expression von Genen, die mit diesem Prozess verbunden sind, bei PLE-Patienten eine mögliche Autoantigen-Quelle darstellen, sowie eine entscheidende Phase in der Initiierung des Autoimmunprozesses, der die Krankheit fördert (3). Nach diesen Erkenntnissen, Kuhn et al. zeigte eine Akkumulation von apoptotischen Zellen bei PLE-Patienten, die entweder mit einer minimalen Erythemdosis (MED) UVB oder 60-100 J/cm2 UVB bestrahlt wurden, im Vergleich zu Kontrollen (5).,
Immunität: Versagen der Toleranz
Auto-Antigene, die aus der ineffizienten Clearance apoptotischer Zellen stammen, werden wahrscheinlich von dendritischen Zellen (DCs) aufgenommen und naiven T-Zellen (zytotoxisch und Helfer) präsentiert danach in autoreaktive T-Zellen transformiert (6, 7). Dieses partielle Versagen der Apoptose trägt zusammen mit der unzureichenden Immunsuppression nach UV-Exposition zur Antigen-Erkennung und-Präsentation bei, was zu der für PLE-Patienten typischen klinischen Manifestation führt (8)., In der Tat wurde das Versagen der normalen UVR-induzierten Immunsuppression als die wichtigste immunologische Anomalie bei PLE nachgewiesen, die zunächst durch die Beständigkeit von Langerhans-Zellen (LCs) in der Epidermis erklärt wurde. Diese Überaktivierung des Immunsystems, die der funktionellen UV-induzierten Verträglichkeit entgeht, ist wahrscheinlich für die verringerte Hautkrebsprävalenz bei PLE-Patienten verantwortlich (9). Andererseits ist derselbe Mechanismus für das Versagen der Unterdrückung der allergischen Kontaktdermatitis (ACD) nach UVR-Exposition verantwortlich (10).,
Entzündungsweg: Überempfindlichkeitsreaktion vom verzögerten Typ
Die an PLE beteiligten immunologischen Mechanismen mit Mediatoren aus dem angeborenen und adaptiven Immunsystem sind entweder aus histologischer oder aus biochemischer Sicht den ACD-Mechanismen sehr ähnlich. In den frühen siebziger Jahren indizierte Epstein PLE erstmals als Überempfindlichkeitsreaktion vom verzögerten Typ (DTHR) gegen undefiniertes UVR-induziertes kutanes Antigen (11). Um dieses Konzept zu verstärken, wurden kürzlich einige der an ACD beteiligten Entzündungsmediatoren auch in PLE nachgewiesen., Zum Beispiel wurde die IL-1-Familie (12, 13), eine wachsende Gruppe von Zytokinen, die mehrere Rollen bei der Immunregulation und Entzündung spielen (14), die auch an der ACD-Pathogenese beteiligt sind (12, 15), auch in PLE (16) untersucht. IL-36α und IL-36γ, die proinflammatorischen Mitglieder der IL-1-Familie, waren in PLE in Bezug auf Kontrollen erhöht, wie für ACD-Proben, aber IL-36γ war in PLE viel verbessert als in ACD (16). Durch den gemeinsamen Rezeptor, der aus IL-36R und IL-1R/AcP (IL-1RL2), IL-36α, IL-36β und IL-36γ besteht, werden NF-kB und MAPKs aktiviert und Entzündungsreaktionen gefördert., Der Anstieg von IL-36s in Haut und peripherem Blut von PLE-Patienten zeigt die Aktivierung der lokalen und systemischen Immunantwort an, wie sie bei multiplen entzündlichen Hauterkrankungen auftritt (15, 17, 18). Wahrscheinlich wird der Zusammenhang zwischen IL-36s-und UVR-Exposition durch das parakrine proinflammatorische Signal der Toll-Like-Rezeptor (TLR)-3-Aktivierung aufgrund der Freisetzung von RNA durch nekrotische Keratinozyten (19) dargestellt. In der Tat könnte das Versagen der apoptotischen Clearance in PLE mit einer Fülle von Zelltrümmern für eine Verstärkung dieses „Alarmsignals“ verantwortlich sein.,“
Darüber hinaus könnten IL-36s dazu beitragen, das angeborene Immunsignal und die daraus resultierende Entzündungskaskade zu verstärken und antimikrobielle Peptide (AMPs) zu fördern (20).
Entzündungsweg: Ampere und Mikrobiom
Diese Mediatoren, die als Defensine (α und β), Cathelicidin (LL37), Ribonuklease 7 (RNase7) und Psoriasin (S100A7) bezeichnet werden, wurden im Lichte des durch UVR induzierten Ungleichgewichts auf Keratinozyten und Hautmikrobiom ebenfalls in PLE (21, 22) untersucht. Patra et al., es wurde festgestellt, dass die Expression von Psoriasin, RNase7, HBD-2 und LL-37 in der PLE-Läsionshaut erhöht war, während HBD-3 verringert war. Betrachtet man die Hautoberfläche als „multiethnische Welt“, ohne die entscheidende Rolle von Keratinozyten zu vergessen, können wir nicht ausschließen, dass die Freisetzung von AMPs durch Modifikation von Mikrobiomkomponenten nach UV-Wechselwirkung bestimmt werden könnte (23). In der Tat könnte das Mikrobiom die direkte oder indirekte Quelle der noch unentdeckten UVR-induzierten Antigene darstellen, die bei PLE-Patienten gebildet werden und zu Keratinozytenschäden führen., Infolgedessen könnte LL-37, ebenfalls induziert durch UVB, IFNy, TNF-α, IL-6, einen potentiellen indirekten Treiber von PLE darstellen (23). Es kann Aggregate mit Selbstnukleinsäuren bilden, die PDCs aktivieren können: Bei Psoriasis wurde es als Hauptautoantigen erkannt (24). Obwohl bei PLE-Patienten über ein vollständiges Fehlen von PDCs berichtet wurde (25), besteht ein Autoimmunmilieu, und LL-37 könnte eine zentrale Rolle spielen und andere Entzündungswege induzieren. In Abbildung S1 (Ergänzungsmaterial) werden die oben ausgedrückten Konzepte in einer Karikatur dargestellt.
Therapie polymorpher Lichtausbrüche: Was gibt es Neues?,
Die erste Behandlungslinie für PLE umfasst Sonnenvermeidung, Sonnenschutzmittel und topische Kortikosteroide (26). Für alle Patienten ist ein vorbeugendes Management bei sonnigem Wetter von grundlegender Bedeutung, indem intensive UVR-Exposition und die Verwendung von Schutzkleidung sowie die Anwendung von Sonnenschutzmitteln, insbesondere während der ersten Exposition des Jahres, vermieden werden. Es wurde berichtet, dass Breitspektrum-Sonnenschutzmittel der neuen Generation mit hohem Sonnenschutzfaktor für UVB (SPF) zusammen mit einem UVA-Schutz mit längerer Wellenlänge bei bis zu 90% der PLE-Patienten einen vollständigen oder teilweisen Schutz bieten (27, 28)., Die Verwendung von oralen Antioxidantien und Nicotinamid könnte eine zusätzliche gültige vorbeugende Maßnahme für diese Patienten darstellen. Die vorteilhaften Wirkungen von Nicotinamid wurden in einer unkontrollierten Studie mit 42 Patienten untersucht, in der 60% von ihnen berichteten, dass die Symptome bei täglicher Einnahme von 2-3 g Nicotinamid vor Sonneneinstrahlung vollständig beseitigt wurden (29). Darüber hinaus hat sich gezeigt, dass ein Extrakt des tropischen Farns Polypodiumleucotomos [PL] sowohl starke antioxidative als auch immunmodulatorische Wirkungen ausübt., Bei Verabreichung mit 480 mg / Tag vor Sonneneinstrahlung reduzierte es signifikant Hautreaktionen und subjektive Symptome (30, 31). In Bezug auf topisches Kortikosteroid werden sie häufig zur Verringerung des Juckreizes eingesetzt, auch wenn keine Studien zur Bestimmung ihrer Wirksamkeit bei PLE durchgeführt wurden (26). Die zweite Behandlungslinie für PLE umfasst systemische Kortikosteroide und Foto(Chemo)Therapie (26). In einer randomisierten, doppelblinden, placebokontrollierten Studie (32) schlugen die Autoren die tägliche Anwendung von 25 mg Prednisolon für 4-5 Tage zu Beginn des Ausbruchs vor., Obwohl die möglichen langfristigen Nebenwirkungen von wiederholten Kursen von Prednisolon in Betracht gezogen werden müssen, könnte es für Patienten, die unter gelegentlichen Anfällen von PLE leiden, in Ermangelung von Kontraindikationen empfohlen werden. In milderen Fällen von PLE kann ein Selbstkonditionierungsprogramm durch direkte Sonneneinstrahlung im Frühjahr ausreichen (33). In schwereren Fällen kann eine medizinisch überwachte Konditionierungs – / Desensibilisierungsbehandlung geeigneter sein., Eine Psoralen-und UVA-Therapie (PUVA), Schmalband – (NB) – UVB-oder Breitband – (BB) – UVB-Phototherapie, die normalerweise im Frühjahr verabreicht wird, kann ebenso wirksam sein wie eine prophylaktische Behandlung (26). Das Behandlungsprotokoll besteht im Allgemeinen aus einem Kurs der Phototherapie/Photochemotherapie über 5-6 Wochen. Die Anfangsdosen hängen von der minimalen Erythemendosis (MED) oder der minimalen phototoxischen Dosis (MPD) ab und betragen häufig 50-70% dieser gemessenen Schwellenwerte mit inkrementellen Erhöhungen., Um den mit der Desensibilisierungstherapie erworbenen Nutzen aufrechtzuerhalten, wird eine regelmäßige Sonneneinstrahlung während des Sommers empfohlen, da sonst die Verhärtung innerhalb von 4-6 Wochen verloren gehen könnte. Bei der Behandlung von PLE sollte NB-UVB PUVA vorgezogen werden (Stärke der Empfehlung D; Evidenzgrad 4), da das Risiko einer Photokarzinogenese geringer ist, kein Risiko für Übelkeit oder andere Nebenwirkungen im Zusammenhang mit der Einnahme von MOP besteht und kein Augenschutz nach der Behandlung erforderlich ist. PUVA sollte jedoch vor anderen systemischen Behandlungen in Betracht gezogen werden, wenn NB-UVB versagt hat oder zuvor den Ausbruch ausgelöst hat., Tatsächlich wurde, wie nachstehend beschrieben, die Wirksamkeit bei mehreren Phototherapieschemata (BB-UVB, NB-UVB und PUVA) nachgewiesen, und es wurden Nebenwirkungen in Bezug auf Hautausschlagsprovokation, Erythem und Juckreiz festgestellt häufiger mit UVB als mit PUVA (34). Wie in der Literatur zusammengefasst, führt die Wirksamkeit von PUVA zu einer Photoprotektionsrate von 65-100% (34)., Es wurden mehrere Vergleichsstudien durchgeführt, aber aus der einzigen randomisierten kontrollierten Studie zwischen PUVA und NB-UVB plus Placebotabletten, die dreimal pro Woche für 5 Wochen durchgeführt wurde, ergab sich kein signifikanter Unterschied in der Wirksamkeit, wenn man bedenkt Auftreten von PLE oder Einschränkung der Aktivität im Freien (35). In den 10 Jahren, eine Retrospektive, berichtet von Mann et al. (36) 170 Patienten mit mittelschwerer bis schwerer PLE erhielten eine PUVA-und/oder UVB-Phototherapie. Im Detail erhielten 8 Patienten PUVA, 128 NB-UVB, 5 BB-UVB und 29 Patienten, die nicht zufriedenstellend auf NB-UVB ansprachen, PUVA im folgenden Jahr., Es wurden Selbsteinschätzungen über den Schweregrad und die Häufigkeit von PLE-Episoden bei den Folgebesuchen im Herbst oder im folgenden Frühjahr durchgeführt. Bei 88% der mit PUVA behandelten Patienten und bei 89%, die UVB erhielten, wurde eine gute oder mäßige Besserung berichtet. Von den Patienten, die sowohl mit PUVA als auch mit NB-UVB behandelt wurden, bevorzugte die Mehrheit PUVA. In einer weiteren 14-jährigen retrospektiven Studie an 79 mit Phototherapie behandelten Patienten (37) betrug die Wirksamkeit, die im folgenden Sommer gemessen wurde, 65% für PUVA, 82% für BB-UVB und 83% für UVA allein., In diesem Fall war die Behandlung mit PUVA schwereren PLE-Formen vorbehalten.
Die Mechanismen, durch die die Phototherapie den Lichtschutz induziert, sind nicht vollständig verstanden.
In den letzten Jahren wurden jedoch viele Fortschritte erzielt. Zusätzlich zu den bekannten Wirkungen auf die Melaninisierung und epidermale Verdickung der Phototherapie wird eine breite Palette von UV-induzierten immunmodulatorischen und entzündungshemmenden Eigenschaften berichtet (38)., Sowohl UVB als auch UVA modulieren die Adhäsionsmolekülexpression und induzieren lösliche Mediatoren wie das a-Melanozyten-stimulierende Hormon IL-10 (das die Produktion von Interferon γ unterdrückt) und Prostaglandin E2, die entzündungshemmende Wirkungen explizieren, die Aktivierung von T-Zellen verhindern und die Apoptose infiltrierender T-Zellen der Haut fördern (34). Darüber hinaus wurde gezeigt, dass das prophylaktische UV-Photohardening bei PLE-Patienten die UV-induzierte LC-Migration von der Epidermis zu den hautableitenden Lymphknoten wiederherstellt: eines der wichtigsten zellulären Ereignisse bei der UV-Immunsuppression (39)., Die durch LC induzierte Toleranz wird durch die Freisetzung von immunsuppressivem Zytokin wie IL-10 und durch die Störung der Reifung und Induktion regulatorischer T-Zellen (Tregs) vermittelt (40). Darüber hinaus wurde kürzlich über einen interessanten Zusammenhang zwischen LC, Tregs und Vitamin D3 berichtet. In der Tat wurde gezeigt, dass eine kurzfristige 1-wöchige topische Vorbehandlung mit dem 1,25-Dihydroxyvitamin-D-Analogon Calcipotriol die PLE-Symptome nach anschließender experimenteller Photoprovokation verringerte (41)., Darüber hinaus zeigte 1,25-Dihydroxyvitamin D in einer murinen Studie vergleichbare immunsuppressive Wirkungen wie UV (42). Ein weiterer interessanter Übersprechen wurde zwischen LCs und Mastzellen hervorgehoben. Neben ihrer anerkannten Rolle in der Atopie sind dermale Mastzellen auch dafür verantwortlich, die Haut vor UVB-induzierten Entzündungen zu schützen und die UV-Immunsuppression zu fördern (40). Studien am Menschen haben gezeigt, dass nach akuter und chronischer UVR-Exposition die Anzahl der dermalen Mastzellen zusammen mit der Freisetzung von IL-10 zunimmt., Insgesamt deuten diese Daten auf eine mögliche Rolle von Mastzellen in PLE und im Mechanismus des Photohardenings hin. In Übereinstimmung damit, Wolf et al. haben erstmals berichtet, dass Photohardening die Mastzelldichte in der papillären Dermis von PLE-Patienten signifikant erhöht (40). Zusammenfassend wirkt Photohardening in PLE, indem es den normalen UV-Immunsuppressivweg wiederherstellt, an dem mehrere Zelltypen beteiligt sind. Die dritte Linie Behandlung für PLE umfasst die Verwendung von systemischen Immunsuppressiva, wie Azathioprin und Cyclosporin., In der Literatur werden jedoch nur sporadische Fälle von erfolgreich behandelten Patienten berichtet (43, 44). Darüber hinaus wurden Hydroxychloroquin, Omega-3-Fettsäuren und Beta-Carotin als Behandlungen vorgeschlagen, aber weitere doppelblinde, randomisierte kontrollierte Studien zur tatsächlichen Beurteilung ihrer klinischen Wirksamkeit sind erforderlich.
Schlussfolgerungen
Da die hohe Prävalenz und die zunehmende Inzidenz von PLE mit Beschwerden und Einschränkungen des Lebensstils einhergehen, sind zukünftige Studien erforderlich, um neue therapeutische und / oder präventive Strategien zu finden., Die Wahl der geeigneten PLE-Behandlung erfordert eine gute Kenntnis des individuellen klinischen Verlaufs der Erkrankung zusammen mit der Möglichkeit, einen Phototest durchzuführen. Einige neue Aspekte bei der möglichen Aktivierung und Förderung des Entzündungsprozesses wurden hervorgehoben.,
Nach dem derzeitigen Kenntnisstand ist es trotz der Identifizierung einiger entscheidender zellulärer Regulationen, die an der Wiederherstellung der Immuntoleranz beteiligt sind, aufgrund fehlender adäquater Studien und der Schwierigkeit, Ergebnismaßnahmen zu bewerten, schwierig, eindeutige Schlussfolgerungen über die Wirksamkeit verschiedener potenzieller Behandlungen in PLE zu ziehen. Der klinische Score zur Beurteilung des PLE-Schweregrads (PLESI) (45) bleibt ein Instrument, das kaum verwendet wird und hauptsächlich auf Forschungszwecke beschränkt ist., Die tiefere Untersuchung der zugrunde liegenden pathogenetischen Mechanismen der Erkrankung wird einen gezielteren Behandlungsansatz ermöglichen.
Author Contributions
SL projizierte das Manuskript, wählte das Material für das Papier aus, schrieb den ersten Entwurf und korrigierte die folgenden Entwürfe des Manuskripts. AR beschäftigte sich mit dem Schreiben des Manuskripts und unterstützte neue Ideen zu Inhalt und Stil.,
Interessenkonflikterklärung
Die Autoren erklären, dass die Untersuchung ohne kommerzielle oder finanzielle Beziehungen durchgeführt wurde, die als potenzieller Interessenkonflikt ausgelegt werden könnten.
Ergänzungsmaterial
Abbildung S1. Wechselspiel zwischen angeborenem und adaptivem Immunsystem im Zusammenhang mit Apoptoseversagen in der Epidermis. (Grünes Symbol) Psoriasin: reichlicher Ausdruck in dornigen und körnigen Hautschichten. (Blaues Symbol) RNase7: hauptsächlich exprimiert in Keratinozyten des Stratum granulosum und des Stratum corneum von PLE-Läsionen., (Gelbes Symbol) LL-37 wurde tief in und um Blutgefäße und Drüsen in PLE ausgedrückt. (Violettes Zellsymbol) Apoptotische Keratinozyten mit ineffizienter Clearance.,hic light eruption; ACD, Allergic contact dermatitis; DTHR, Delayed type hypersensitivity reaction; UVR, Ultraviolet radiation; C1s, Complement 1s subunit; SCARB1, Scavenger receptor B1; FN1, Fibronectin; IGSF3, Immunoglobulin superfamily member 3; CASP1, Caspase-1; PON2, Paraoxonase 2; MED, Minimal Erythema Dose; DCs, Dendritic cells; LCs, Langerhans cells; TLR, Toll like receptor; AMPs, Antimicrobial peptides; SPF, Sun protection factor; PUVA, Psoralen and UVA therapy; NB-UVB, Narrowband; BB-UVB, Broadband UVB; MPD, Minimum phototoxic dose; Tregs, Regulatory T cells; PL, Polypodiumleucotomos.,
2. McGregor JM, Grabczynska S, Vaughan R, Hawk JL, Lewis CM. Genetic modelling of abnormal photosensitivity in families with polymorphic light eruption and actinic prurigo. J Invest Dermatol. (2000) 115:471–6. doi: 10.1046/j.1523-1747.2000.00080.x
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Lembo S, Hawk JLM, Murphy GM, Kaneko K, Young AR, McGregor JM, et al., Aberrant gene expression with deficient apoptotic keratinocyte clearance may predispose to polymorphic light eruption. Br J Dermatol. (2017) 177:1450–3. doi: 10.1111/bjd.15200
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Savill J, Fadok V. Corpse clearance defines the meaning of cell death. Nature (2000) 407:784–8. doi: 10.,1038/35037722
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Kuhn A, Herrmann M, Kleber S, Beckmann-Welle M, Fehsel K, Martin-Villalba A, et al. Accumulation of apoptotic cells in the epidermis of patients with cutaneous lupus erythematosus after ultraviolet irradiation. Arthritis Rheum. (2006) 54:939–50. doi: 10.1002/art.21658
PubMed Abstract | CrossRef Full Text | Google Scholar
6., Savill J, Dransfield I, Gregory C, Haslett C. A blast from the past: clearance of apoptotic cells regulates immune responses. Nat RevImmunol. (2002) 2:965–75. doi: 10.1038/nri957
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Albert ML, Sauter B, Bhardwaj N. Dendritic cells acquire antigen from apoptotic cells and induce class I-restricted CTLs. Nature (1998) 392:86–9. doi: 10.,1038/32183
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Koulu LM, Laihia JK, Peltoniemi HH, Jansén CT. UV-induced tolerance to a contact allergen is impaired in polymorphic light eruption. J Invest Dermatol. (2010) 130:2578–82. doi: 10.1038/jid.2010.181
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Epstein JH. Polymorphous light eruption. J Am Acad Dermatol. (1980) 3:329–43.,
PubMed Abstract | Google Scholar
12. Mattii M, Ayala F, Balato N, Filotico R, Lembo S, Schiattarella M, et al. The balance between pro- and anti-inflammatory cytokines is crucial in human allergic contact dermatitis pathogenesis: the role of IL-1 family members. Exp Dermatol. (2013) 22:813–9. doi: 10.1111/exd.12272
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Dinarello CA., Interleukin-1 in der Pathogenese und Behandlung von entzündlichen Erkrankungen. Blut (2011) 117:3720-32. doi: 10.1182 / Blut-2010-07-273417
PubMed Abstract | CrossRef Volltext | Google Scholar
16. Lembo S, Caiazzo G, Balato N, Monfrecola G, Patra V, Wolf P, et al. Polymorphe Lichtausbrüche und IL-1-Familienmitglieder: Gibt es Unterschiede bei allergischer Kontaktdermatitis? Photochem Photobiol Sci. (2017) 16:1471–9. doi: 10.,1039/c7pp00142h
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Balato A, Schiattarella M, Lembo S, Mattii M, Prevete N, Balato N, et al. Interleukin-1 family members are enhanced in psoriasis and suppressed by vitamin D and retinoic acid. Arch Dermatol Res. (2013) 305:255–62. doi: 10.1007/s00403-013-1327-8
PubMed Abstract | CrossRef Full Text | Google Scholar
19., Borkowski AW, Kuo IH, Bernard JJ, Yoshida T, Williams MR, Hing NJ. Eine mautähnliche Rezeptor-3-Aktivierung ist für eine normale Reparatur der Hautbarriere nach UV-Schäden erforderlich. J. Invest Dermatol. (2015) 135:569–78. doi: 10.1038/jid.2014.354
PubMed Abstract | CrossRef Volltext | Google Scholar
20. Li N, Yamasaki K, Saito R, Fukushi-Takahashi S, Shimada-Omori R, Asano M, et al. Alarmin funktion von cathelicidin antimikrobielle peptid LL37 durch IL-36γ induktion in menschlichen epidermalen keratinozyten. J Immunol., (2014) 193:5140–8. doi: 10.4049/jimmunol.1302574
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Patra V, Wolf P. Microbial elements as the initial triggers in the pathogenesis of polymorphic light eruption? Exp Dermatol. (2016) 25:999–1001. doi: 10.1111/exd.13162
PubMed Abstract | CrossRef Full Text | Google Scholar
22., Gläser R, Navid F, Schuller W, Jantschitsch C, Harder J, Schröder JM, et al. UV-B-Strahlung induziert die Expression von antimikrobiellen Peptiden in menschlichen Keratinozyten in vitro und in vivo. J Allergie Clin Immunol. (2009) 123:1117–23. doi: 10.1016 / j. jaci.2009.01.043
PubMed Abstract / CrossRef Volltext / Google Scholar
23. Patra V, Mayer G, Gruber-Wackernagel A, Horn M, Lembo S, Wolf P., Einzigartiges Profil der antimikrobiellen Peptidexpression bei polymorphen Lichtausbruchsläsionen im Vergleich zu gesunder Haut, atopischer Dermatitis und Psoriasis. Photodermatol Photoimmunol Photomed. (2018) 34:137–44. doi: 10.111/phpp.12355
PubMed Abstract | CrossRef Volltext | Google Scholar
25. Schweintzger NA, Gruber-Wackernagel A, Shirsath N, Quehenberger F, Obermayer-Pietsch B, Wolf P. Einfluss der Jahreszeiten auf den vitamin-D-Spiegel und regulatorische T-Zellen bei Patienten mit polymorpher lichtdermatose., Photochem Photobiol Sci. (2016) 15:440–6. doi: 10.1039/c5pp00398a
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Proby C, Baker C, Morton O, Hawk JLM. New broad spectrum sunscreen for polymorphic light eruption. Lancet (1993) 341:1347–8.
PubMed Abstract | Google Scholar
28. Allas S, Lui H, Moyal D, Bissonnette R., Vergleich der Fähigkeit von 2 Sonnenschutzmitteln, vor polymorphem Lichtausbruch zu schützen, der durch eine UV-A/UV-B-Metallhalogenidlampe induziert wird. Arch Dermatol. (1999) 135:1421–2.
PubMed Abstract | Google Scholar
29. Ortel B, Wechdorn D, Tanew A, Honigsmann H. Wirkung von Nicotinamid auf die Phototestreaktion bei polymorpher Lighteruption. Br J Dermatol. (1988) 118:669–73.
PubMed Abstract | Google Scholar
30., Caccialanza M, Percivalle S, Piccinno R, Brambilla R. Photoprotective activity of oral Polypodiumleucotomos extract in 25 patients with idiopathic photodermatoses. Photodermatol Photoimmunol Photomed. (2007) 23:46–7. doi: 10.1111/j.1600-0781.2007.00274.x
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Tanew A, Radakovic S, Gonzalez S, Venturini M, Calzavara-Pinton P. Oral administration of a hydrophilic extract of Polypodiumleucotomos for the prevention of polymorphic light eruption., J Am Acad Dermatol. (2012) 66:58–62. doi: 10.1016/j.jaad.2010.09.773
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Van Praag MCG Boom, BW, Vermeer BJ. Diagnosis and treatment of polymorphous light eruption. Int J Dermatol. (1994) 33:233–9.
Google Scholar
34. Ling TC, Clayton TH, Crawley J, Exton LS, Goulden V, Ibbotson S, et al., British association of Dermatologen und british photodermatology group-Richtlinien für die sichere und wirksame Anwendung von psoralen-UV-A-Therapie 2015. Br J Dermatol. (2016) 174:24–55. doi: 10.111 / bjd.14317
PubMed Abstract | CrossRef Volltext | Google Scholar
36. Man I, Dawe RS, Ferguson J. Künstliche Härtung für polymorphen Lichtausbruch: praktische Punkte aus zehn Jahren Erfahrung. Photodermatol Photoimmunol Photomed. (1999) 15:3–4.,
PubMed Abstract | Google Scholar
37. Mastalier U, Kerl H, Wolf P. Clinical laboratory, phototest and phototherapy findings in polymorphic light eruptions: a retrospective study of 133 patients. Eur J Dermatol. (1998) 8:554–9.
PubMed Abstract | Google Scholar
38. Krutmann J, Morita A. Mechanisms of ultraviolet (UV) B and UVA phototherapy. J Invest Dermatol Symp Proc. (1999) 4:70–2.,
PubMed Abstract | Google Scholar
39. Janssens AS, Pavel S, Out-Luiting JJ, Willemze R, de Gruijl FR. Normalized ultraviolet (UV) induction of Langerhans cell depletion and neutrophil infiltrates after artificial UVB hardening of patients with polymorphic light eruption. Br J Dermatol. (2005) 152:1268–74. doi: 10.1111/j.1365-2133.2005.06690.x
PubMed Abstract | CrossRef Full Text | Google Scholar
40., Wolf P, Gruber-Wackernagel A, Bambach ich, Schmidbauer U, Mayer G, Absenger M, et al. Photohardening von Patienten mit polymorphem Lichtausbruch verringert die epidermale Langerhans-Zelldichte zu Studienbeginn und erhöht gleichzeitig die Mastzellzahl in der papillären Dermis. Exp Dermatol. (2014) 23:428–30. doi: 10.111/exd.12427
PubMed Abstract | CrossRef Volltext | Google Scholar
42. Schwarz A, Navid F, Sparwasser T, Clausen BE, Schwarz T., 1,25-dihydroxyvitamin D exerts similar immunosuppressive effects as UVR but is dispensable for local UVR-induced immunosuppression. J Invest Dermatol. (2012) 132, 2762–9. doi: 10.1038/jid.2012.238
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Norris PG, Hawk JL. Successful treatment of severe polymorphous light eruption with azathioprine. Arch Dermatol. (1989) 125:1377–9.
PubMed Abstract | Google Scholar