Substitution nucléophile du groupe hydroxyle
le comportement chimique des halogénures d’alkyle peut être utilisé comme référence dans la découverte de réactions analogues de substitution et d’élimination des alcools. La principale différence, bien sûr, est un changement dans l’anion partant de l’halogénure à l’hydroxyde. Comme l’oxygène est légèrement plus électronégatif que le chlore (3,5 contre 2,8 sur L’échelle de Pauling), la liaison C-O devrait être plus polaire qu’une liaison C-Cl., De plus, une mesure indépendante des caractéristiques électrophiles des atomes de carbone à partir de leurs déplacements chimiques RMN (protons 13C et alpha) indique que les substituants de l’oxygène et du chlore exercent une influence similaire de retrait d’électrons lorsqu’ils sont liés à des atomes de carbone hybridés sp3. Malgré ces preuves de fond prometteuses, les alcools ne subissent pas les mêmes réactions SN2 couramment observées avec les halogénures d’alkyle. Par exemple, la réaction rapide SN2 du 1-bromobutane avec le cyanure de sodium, illustrée ci-dessous, n’a pas de parallèle lorsque le 1-butanol est traité avec du cyanure de sodium., En fait, l’alcool éthylique est souvent utilisé comme solvant pour des réactions de substitution aux halogénures d’alkyle telles que celle-ci.
CH3CH2CH2CH2–M + Na(+) CN(–)  CH3CH2CH2CH2–CN + Na(+) Br(–)
CH3CH2CH2CH2–CN + Na(+) Br(–)
CH3CH2CH2CH2–OH + Na (+) (CN–)  Pas de Réaction
Pas de Réaction
Le facteur clé ici est la stabilité de l’abandon de l’anion (bromure de vs hydroxyde de)., L’HBr est un acide beaucoup plus fort que l’eau (de plus de 18 ordres de grandeur), et cette différence se reflète dans les réactions qui génèrent leurs bases conjuguées respectives. La base la plus faible, le bromure, est plus stable, et sa libération dans une réaction de substitution ou d’élimination est beaucoup plus favorable que celle de l’ion hydroxyde, une base plus forte et moins stable.
une étape claire vers l’amélioration de la réactivité des alcools dans les réactions SN2 serait de modifier le groupe fonctionnel –OH de manière à améliorer sa stabilité en tant qu’anion partant., Une telle modification consiste à effectuer la réaction de substitution dans un acide fort, en convertissant –OH EN –OH2(+). Parce que l’ion hydronium (H3O (+)) est un acide beaucoup plus fort que l’eau, sa base conjuguée (H2O) est un meilleur groupe de départ que l’ion hydroxyde. Le seul problème avec cette stratégie est que de nombreux nucléophiles, y compris le cyanure, sont désactivés par protonation dans les acides forts, éliminant efficacement le co-réactif nucléophile nécessaire à la substitution., Les acides forts HCl, HBr et HI ne sont pas soumis à cette difficulté car leurs bases conjuguées sont de bons nucléophiles et sont des bases encore plus faibles que les alcools. Les équations suivantes illustrent certaines réactions de substitution des alcools qui peuvent être affectés par ces acides. Comme pour les halogénures d’alkyle, la substitution nucléophile des alcools 1º procède par un mécanisme SN2, tandis que les alcools 3º réagissent par un mécanisme SN1. Les réactions des alcools 2º peuvent se produire par les deux mécanismes et produisent souvent des produits réarrangés., Les chiffres entre parenthèses à côté des formules d’acides minéraux représentent le pourcentage en poids d’une solution aqueuse concentrée, la forme sous laquelle ces acides sont normalement utilisés.
bien que ces réactions soient parfois appelées « catalysées par l’acide », ce n’est pas strictement correct. Dans la transformation globale, un acide HX fort est converti en eau, un acide très faible, donc au moins une quantité stœchiométrique de HX est nécessaire pour une conversion complète de l’alcool en halogénure d’alkyle., La nécessité d’utiliser des quantités équivalentes d’acides très forts dans cette réaction limite son utilité aux alcools simples du type représenté ci-dessus. Les alcools avec des groupes sensibles à l’acide ne tolèrent bien sûr pas un tel traitement. Néanmoins, l’idée de modifier le groupe fonctionnel-OH pour améliorer sa stabilité en tant qu’anion partant peut être poursuivie dans d’autres directions. Le diagramme suivant montre quelques modifications qui se sont révélées efficaces. Dans chaque cas, le groupe hydroxyle est converti en un ester d’un acide fort. Les deux premiers exemples montrent les esters de sulfonate décrits précédemment., Les troisième et quatrième exemples montrent la formation d’un ester de phosphite (X représente les Bromes restants ou les substituants d’alcool supplémentaires) et d’un ester de chlorosulfite, respectivement. Tous ces groupes de départ (colorés en bleu) ont des acides conjugués beaucoup plus forts que l’eau (de 13 à 16 puissances de dix); ainsi, l’anion de départ est en conséquence plus stable que l’ion hydroxyde. Les composés mésylate et tosylate sont particulièrement utiles car ils peuvent être utilisés dans des réactions de substitution avec une grande variété de nucléophiles., Les intermédiaires produits dans les réactions des alcools avec le tribromure de phosphore et le chlorure de thionyle (deux derniers exemples) sont rarement isolés, et ces réactions continuent à produire des produits de bromure d’alkyle et de chlorure.
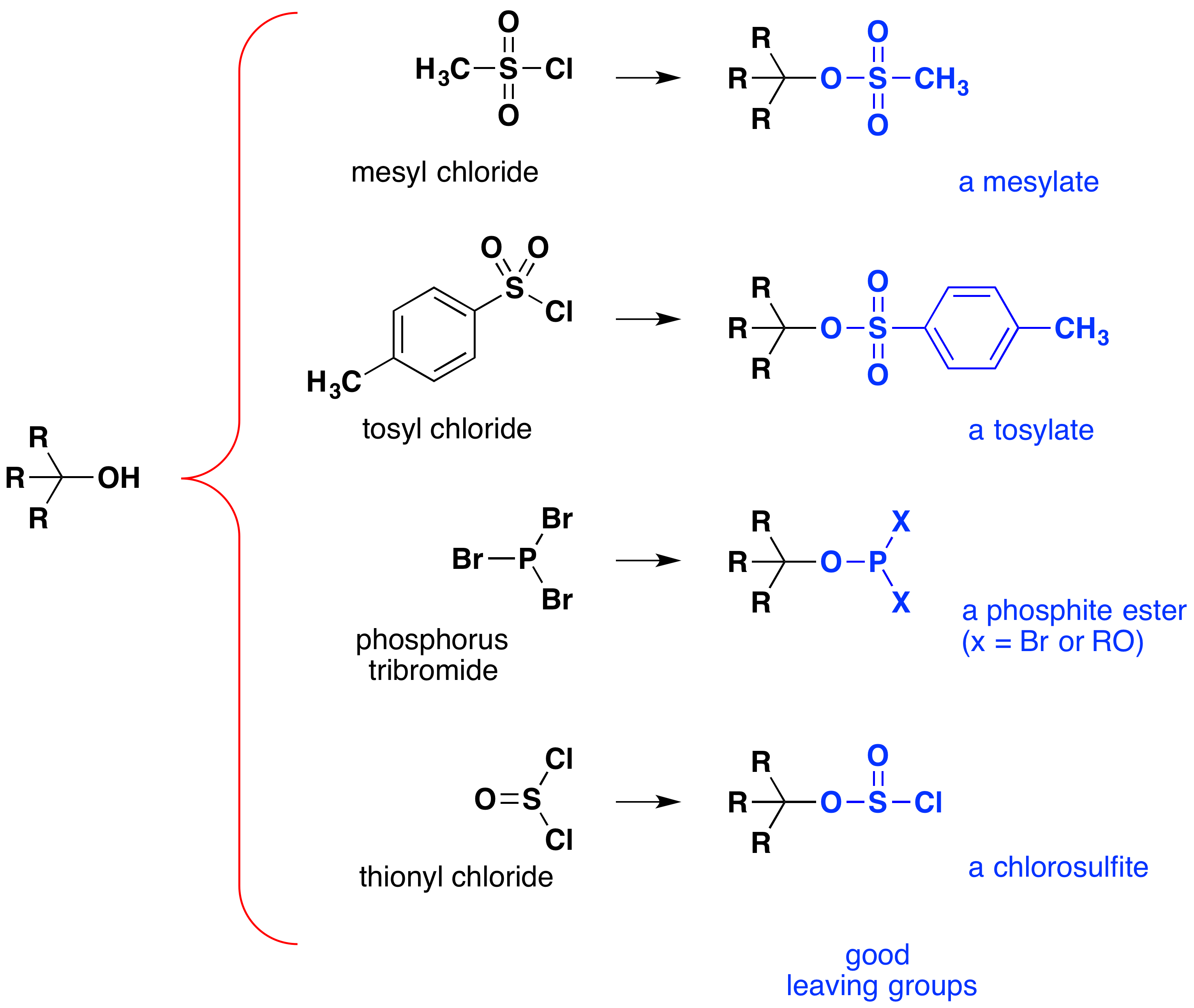
l’importance des intermédiaires ester sulfonés dans les réactions de substitution nucléophiles générales des alcools peut être illustrée par la conversion suivante du 1-butanol en pentanénitrile (cyanure de butyle), réaction qui ne se produit pas avec l’alcool seul., Les halogénures de phosphore et de thionyle, quant à eux, n’agissent que pour convertir les alcools en halogénures d’alkyle correspondants.,
| CH3CH2CH2CH2–OH + CH3SO2Cl | pyridine
|
CH3CH2CH2CH2–OSO2CH3 | Na(+) CN(–)
|
CH3CH2CH2CH2–CN + CH3SO2O(–) Na(+) |
Some examples of alcohol substitution reactions using this approach to activating the hydroxyl group are shown in the following diagram., Les deux premiers cas servent à renforcer le fait que les dérivés d’ester de sulfonate d’alcools peuvent remplacer les halogénures d’alkyle dans une variété de réactions SN2. Les deux cas suivants démontrent l’utilisation du tribromure de phosphore dans la conversion des alcools en bromures. Ce réactif peut être utilisé sans base ajoutée (p. ex. pyridine) car le produit de l’acide phosphoreux est un acide plus faible que L’HBr. Le tribromure de phosphore est mieux utilisé avec les alcools 1º, car les alcools 2º produisent souvent des sous-produits de réarrangement résultant de réactions SN1 concurrentes., On notera que l’éther oxygène dans la réaction 4 n’est pas affecté par ce réactif, alors que la synthèse alternative utilisant l’HBR concentré clive les éthers. Le trichlorure de phosphore (PCl3) convertit les alcools en chlorures d’alkyle d’une manière similaire, mais le chlorure de thionyle est généralement préféré pour cette transformation car les produits inorganiques sont des gaz (SO2 & HCl). Le triiodure de phosphore n’est pas stable mais peut être généré in situ à partir d’un mélange de phosphore rouge et d’iode et agit pour convertir les alcools en iodures d’alkyle., Le dernier exemple montre la réaction du chlorure de thionyle avec un 2º-alcool chiral. La présence d’une base organique telle que la pyridine est importante car elle fournit une concentration substantielle d’ion chlorure nécessaire à la réaction finale SN2 de l’intermédiaire chlorosufite., En l’absence de base, les chlorosufites se décomposent lors du chauffage pour donner le chlorure d’alkyle attendu avec rétention de la configuration
les alcools tertiaires ne sont pas couramment utilisés pour les réactions de substitution du type discuté ici car les chemins de réaction SN1 et E1 sont dominants et difficiles à contrôler.

L’importance de sulfonate esters comme intermédiaires dans de nombreuses réactions de substitution ne peut pas être surestimée., Une preuve rigoureuse de l’inversion configurationnelle qui se produit au site de substitution dans les réactions SN2 utilise de telles réactions. Un exemple d’une telle preuve est affiché en dessous. Les abréviations pour les dérivés de sulfonyle les plus couramment utilisés sont données dans le tableau suivant.
| Sulfonyle Groupe | CH3SO2– | CH3C6H4SO2– | BrC6H4SO2– | CF3SO2– |
|---|---|---|---|---|
| Nom & Abrév., | Mesyl ou Ms | Tosyl ou Ts | Brosyl ou Bs | Trifyl ou Tf |
Inversion de la Preuve

Pour une discussion plus complète des hydroxyles des réactions de substitution et d’une description des autres méthodes sélectives de cette transformation, Cliquez Ici.
les Contributeurs
- William Reusch, Professeur Émérite (université d’Etat du Michigan U.,), Virtual Textbook of Organic Chemistry