La fibrillation auriculaire non valvulaire (NVAF) est l’arythmie la plus fréquente en Espagne. L’Incidence est étroitement liée à l’âge, avec une prévalence proche de 25% chez les patients âgés de plus de 80 ans.1 parmi les nombreux processus associés à la NVAF, l’accident vasculaire cérébral d’origine cardioembolique est probablement la complication la plus grave car il entraîne des taux élevés d’invalidité et de mortalité.,2 Un autre problème associé à la fibrillation auriculaire est la nécessité d’un traitement anticoagulant oral (CAO) pour prévenir les événements cardioemboliques. Ce besoin augmente avec l’âge avancé car le risque d’un événement est encore plus grand.1 de plus, le risque de complications associées à un traitement anticoagulant, en particulier de saignement, augmente également chez ces patients.3 actuellement, l’occlusion de l’appendice auriculaire gauche percutané (LAA) est une alternative pour les patients atteints de NVAF et de contre-indications au traitement par la CAO.,4,5
traitement anticoagulant ORAL: efficacité et limites
le traitement anticoagulant avec des antagonistes de la vitamine K est considéré comme le traitement standard de la NVAF. Les principaux problèmes avec ces médicaments sont le risque accru de saignement, la nécessité de contrôles réguliers, l’interaction avec la nourriture ou d’autres médicaments et l’instabilité de l’action du médicament dans certains cas. On estime qu’entre 30% et 50% des patients indiqués pour la CAO ne les reçoivent pas.6 avec l’introduction de nouveaux anticoagulants tels que le dabigatran,7 l’apixaban,8 et le rivaroxaban,9 la prise en charge de ces patients pourrait changer., Quoi qu’il en soit, et malgré leur profil d’action plus stable et plus sûr, le risque hémorragique, avec un taux annuel compris entre 2,1% et 3,6%, continue d’être le principal talon d’Achille de ces nouveaux agents (tableau). En fait, des registres plus récents indiquent que l’incidence des événements cardioemboliques et des hémorragies secondaires au dabigatran pourrait être similaire à celle de la warfarine.10 malgré l’introduction de nouveaux anticoagulants, le pourcentage de patients indiqués pour la CAO mais ne recevant pas de traitement reste d’environ 40%.,11 face à une mauvaise observance du traitement et au risque persistant d’hémorragie, le besoin d’alternatives au traitement anticoagulant est devenu une priorité pour ces patients.
appendice auriculaire gauche: fonction, anatomie et INDICATIONS d’OCCLUSION
la LAA est un vestige embryologique et sa fonction principale est de contrôler le volume sanguin. Il est situé très près de l’artère circonflexe gauche, bordant au niveau supérieur la veine pulmonaire supérieure gauche et au niveau inférieur la valve mitrale., La morphologie de LAA est extraordinairement hétérogène d’un patient à l’autre et il y a souvent plus d’un lobe. Dans le rythme sinusal, le LAA est une structure contractile qui vide son contenu à chaque battement de cœur. Dans la fibrillation auriculaire, Laa perd sa capacité contractile et se dilate, entraînant un ralentissement du flux sanguin, avec pour conséquence un risque accru de thrombose. Dans les études de pathologie des patients atteints de NVAF, 91% des thrombus situés dans l’oreillette gauche se trouvent dans le LAA., Cela a conduit à la croyance que l’occlusion percutanée de LAA pourrait être une stratégie efficace pour prévenir le risque cardioembolique chez les patients atteints de NVAF.
L’occlusion percutanée de LAA en est encore à son stade initial et quelques années doivent encore s’écouler avant que nous puissions avoir une vision plus fiable de son rôle chez les patients atteints de NVAF. Même si, à l’avenir, il pourrait constituer une véritable alternative pour les patients sans contre-indication à la CAO, son utilisation devrait actuellement être réservée aux patients présentant des contre-indications au traitement anticoagulant, comme recommandé dans les directives européennes (indication IIb).,5 en effet, la plupart des interventions chez les patients recevant un traitement anticoagulant sont référées soit par le service de neurologie après un épisode de saignement intracrânien, soit par la gastro-entérologie suite à l’observation d’un saignement digestif récurrent sans cause traitable. L’absence d’alternatives valides à la CAO pour prévenir le risque cardioembolique, qui est généralement élevé car il s’agit généralement de patients plus âgés présentant de multiples pathologies, fait de l’occlusion de LAA une option très attrayante pour ces patients., Le rapport international normalisé Labile ou l’apparition d’un événement cardioembolique malgré le traitement OAC et le rapport international normalisé adéquat sont d’autres contextes dans lesquels l’occlusion percutanée de LAA pourrait être justifiée. Dans tous les cas, des décisions multidisciplinaires et individualisées sont nécessaires pour évaluer à la fois le risque cardioembolique et hémorragique et d’autres facteurs essentiels tels que l’efficacité du traitement, la fragilité du patient ou l’observance du traitement, en particulier avec la CAO.
dispositifs percutanés D’occlusion de L’appendice auriculaire gauche
le dispositif PLAATO™ a été le premier occluder percutané de LAA (Fig. 1)., Malgré de bons résultats préliminaires en termes d’efficacité et de sécurité, le programme de développement a été suspendu et l’appareil a disparu du marché.
actuellement, les deux dispositifs les plus fréquemment utilisés dans le monde sont le système Watchman™ (Boston Scientific; Boston, Massachusetts, États-Unis) et le bouchon cardiaque Amplatzer™ (ACP) (St.Jude Medical; Minneapolis, Minnesota, États-Unis) (Fig. 1). Comme le système PLAATO™, les deux sont implantés par voie transseptale en utilisant l’accès à la veine fémorale., Les deux prothèses sont très flexibles et disposent d’un système de guides stabilisateurs qui s’ancrent à la paroi de LAA et évitent ainsi l’embolisation. La principale différence entre les deux appareils réside toutefois dans leur forme. Le système Watchman™ est implanté à 10 mm de l’ostium de LAA, et ne le recouvre donc pas; L’ACP contient un lobe qui est implanté à 10-15 mm de l’ostium et un disque qui recouvre complètement l’ostium de LAA (Fig. 2). Un ACP de deuxième génération appelé Amplatzer™ Amulet™ est récemment apparu sur le marché. Le dispositif Amulet™ (fig., 1) est également en forme de lobe et a un disque comme L’ACP, mais a des modifications qui facilitent la préparation et l’implantation du dispositif et, en même temps, minimisent le risque d’embolisation et de thrombose.
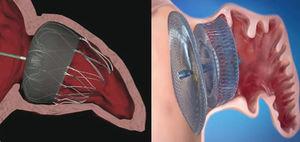
Position des bouchons cardiaques Watchman™ et Amplatzer™ après implantation dans l’appendice auriculaire gauche., Veilleur™ appareil implanté à 10 mm de l’ostium de l’auricule gauche (à gauche) et Amplatzer™ Cardiaque Branchez l’appareil avec le lobe implanté à 10 mm de l’ostium et le disque qui couvre l’entrée de l’auricule gauche (à droite).
de Nombreux registres attestent de l’efficacité et de l’innocuité du Gardien™ système et les pays ACP, mais les deux nécessitent un non-négligeable de l’implantation de la courbe d’apprentissage., L’étude PROTECT AF,12 la seule étude randomisée à comparer la warfarine avec l’occlusion de Laa (Watchman™) chez les patients atteints de NVAF, a montré que l’occlusion de LAA n’est pas moins réussie que la warfarine concernant l’objectif principal (accident vasculaire cérébral combiné, embolie systémique et décès cardiovasculaire ou inexpliqué) mais a montré un taux inquiétant d’événements périprocéduraux, avec 4,4% d’incidence d’épanchement péricardique sévère., Ce problème initial a été attribué à la courbe d’apprentissage de l’opérateur: avec l’expérience de l’opérateur, le taux de complication a diminué et le pourcentage d’implantations réussies s’est considérablement amélioré. Actuellement (pour les deux dispositifs), plus de 95% des implantations sont généralement réussies et le taux d’épanchement péricardique sévère est
considérations techniques
la technique d’occlusion percutanée de LAA nécessite une équipe ayant de l’expérience dans les maladies congénitales/structurelles., Bien que certains groupes utilisent uniquement l’échocardiographie intracardiaque, ou même le contrôle angiographique, pour guider la procédure et éviter l’intubation du patient, la plupart des centres utilisent l’échocardiographie transœsophagienne (TEE) sous anesthésie générale. Structurellement, le LAA a des parois très fines et une morphologie hétérogène qui peut cacher des microthromboses du TEE. L’expérience de l’opérateur est essentielle pour minimiser la manipulation dans le LAA et ainsi réduire le risque de perforation et d’embolie périprocédurale., Deux des facteurs les plus importants qui minimisent la manipulation dans le LAA sont les suivants: a) une ponction transseptale postérieure basse qui facilite une approche frontale du LAA, et b) une étude détaillée du LAA, si possible avec TEE et angiographie, afin d’établir la morphologie du LAA et d’obtenir des mesures précises qui facilitent la sélection de la taille Il est recommandé de prendre des mesures à un volume sanguin normal, car la taille de LAA peut varier considérablement en fonction du niveau d’hydratation du patient., Au cours de la procédure, les patients ont tendance à se déshydrater; il est donc recommandé de déterminer la pression auriculaire gauche et d’administrer du liquide pour maintenir une pression >de 10 mmHg avant de prendre les mesures.
Il s’agit d’une procédure relativement nouvelle et, même si TEE est la norme d’imagerie, le mode d’imagerie idéal reste inconnu. La morphologie de LAA est ovale chez 80% des patients, de sorte que les diamètres varient généralement en raison des axes courts et longs. Cette différence peut passer inaperçue avec les techniques d’imagerie en 2 dimensions., Comme dans les procédures comme le remplacement de la valve aortique percutanée, la té tridimensionnelle ou la tomographie cardiaque peuvent fournir des informations spatiales qui peuvent aider à optimiser la stratégie d’implantation et la sélection de la taille du dispositif.
l’importance des fuites périprothétiques pendant le suivi reste incertaine. Une sous-analyse de L’étude PROTECT AF n’a révélé aucune relation entre les fuites et l’apparition d’événements cliniques., En revanche, dans les études sur les résultats de la chirurgie coronarienne, l’excision incomplète de LAA chez les patients ayant subi une occlusion chirurgicale prophylactique de LAA a été associée à un taux plus élevé d’événements cardioemboliques. En attendant que de nouvelles études soient disponibles qui pourraient confirmer ou non cette relation, nous devrions essayer de prévenir les fuites périprothétiques. Par conséquent, il est recommandé que le dispositif soit un peu plus grand que le TEE et que les mesures angiographiques ne le suggèrent, car cela permet de réduire le taux de fuites résiduelles sans augmenter le risque de rupture de la paroi de LAA.,13
Les recommandations antithrombotiques Postprocédurales sont une autre question controversée. Dans L’étude PROTECT AF, des CAO ont été administrés pendant 45 jours en postimplantation et suspendus si le TEE présentait une occlusion adéquate de LAA.12 récemment, L’étude ASAP a montré que 45 jours de traitement OAC peuvent remplacer le traitement antiplaquettaire double (100 mg/jour d’acide acétylsalicylique et 75 mg/jour de clopidogrel).14 actuellement, la plupart des centres recommandent des antiplaquettaires doubles pendant 1 à 3 mois et une monothérapie antiplaquettaire indéfinie., La thrombose de l’appareil est une complication peu fréquente mais a été décrite à la fois dans les dispositifs Watchman™ et ACP. Bien que cette complication soit résolue par 2 semaines de traitement anticoagulant chez la plupart des patients, le risque potentiel d’embolie due à la migration du thrombus en fait l’une des complications les plus redoutées., Dans la seule série espagnole rapportée, un taux alarmant de thrombose du dispositif a été observé chez 14% des patients, contrairement aux 15 cette différence dans le pourcentage de thrombose pourrait être due à une différence de sensibilité de détection: dans le registre espagnol, le protocole de suivi du TEE était beaucoup plus long (24 h et 1, 3, 6 et 12 mois) que dans la plupart des centres étudiés, où le TEE était utilisé pendant 3 à 6 mois.,15 étant donné que la plupart des cas de thrombose sont survenus à =3 mois et que tous ont été résolus par l’administration d’héparine de sodium ou d’énoxaparine pendant 2 semaines, la détermination de la faisabilité de 3 mois de traitement anticoagulant ou d’un suivi plus exhaustif pourrait être une option future, une fois la véritable incidence de la thrombose Dans tous les cas, une évaluation multidisciplinaire et individualisée est nécessaire chez les patients de ce type, qui présentent parfois un risque de saignement si élevé que même de courtes périodes de traitement anticoagulant pourraient être contre-indiquées.,
CONCLUSIONS et perspectives d’avenir
même si la NVAF est déjà l’une des maladies les plus fréquentes dans notre société, sa prévalence va augmenter dans les années à venir en raison du vieillissement progressif de la population. Pour différentes raisons, entre 30% et 50% des patients indiqués pour la CAO ne les prennent pas. Aujourd’hui, l’occlusion de LAA constitue une alternative pour les patients atteints de NVAF et de contre-indications au traitement anticoagulant., L’occlusion de LAA est une procédure efficace et sûre, mais elle nécessite une équipe expérimentée en cardiologie interventionnelle structurelle et est associée à une courbe d’apprentissage substantielle pour l’opérateur.
à l’avenir, l’occlusion de LAA pourrait être une alternative au traitement de la CAO pour tous les patients atteints de NVAF. Bien que L’étude PROTECT AF ait déjà prouvé que l’efficacité de l’occlusion de LAA n’est pas inférieure à celle du traitement anticoagulant, la courbe d’apprentissage initiale a conditionné un taux de complication périprocédurale élevé., Deux nouvelles études randomisées—PREVAIL et ACP—compareront spécifiquement l’occlusion de LAA avec le traitement OAC chez les patients atteints de NVAF une fois que la courbe d’apprentissage de la procédure initiale a été surmontée. L’étude PREVAIL compare le dispositif Watchman™ à la warfarine, et ACP compare le dispositif ACP à la warfarine et au dabigatran. Si les résultats des deux études montrent que l’occlusion de LAA n’est pas moins efficace que la thérapie anticoagulante chez les patients atteints de NVAF, l’utilisation de la procédure pourrait être prolongée et elle pourrait devenir une alternative à la thérapie anticoagulante pour les patients présentant un profil de risque plus faible.,
conflits d’intérêts
Xavier Freixa est proctor de St.Jude Medical.