les atomes et L’énergie lumineuse
l’étude des atomes et de leurs caractéristiques recoupent plusieurs differentsciences. Les chimistes, les physiciens et les astronomes doivent tous comprendre l’échelle microscopique à laquelle une grande partie de l’univers fonctionne afin de voir « une image plus grande ».,
l’Intérieur de l’Atome
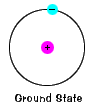 |
L’état d’un électron, le niveau d’énergie itnormally occupe, c’est l’état de plus basse énergie de l’électron. |
| il y a aussi une énergie maximale que chaque électron peut avoir et faire toujours partie de son atome. Au-delà de cette énergie, l’électronis n’est plus lié au noyau de l’atome et il est considéré comme ionisé., | 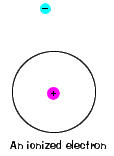 |
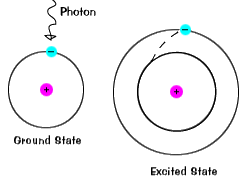 |
Lorsqu’un électron occupe temporairement un État d’énergie supérieur à itsground état, il est dans un excité state.An l’électron peut devenir excité s’il reçoit une énergie supplémentaire, par exemple s’ilabsorbe un photon, ou un paquet de lumière, ou entre en collision avec un atome ou une particule à proximité. |
l’Énergie de la Lumière
Les illustrations de cette page sont des versions simplifiées de Real atoms,bien sûr. Les atomes réels, même relativement simples comme l’hydrogène, ont de nombreuses orbitales différentes, et il existe donc de nombreuses énergies possiblesavec différents états initiaux et finaux., Quand un atome est excitéétat, l’électron peut tomber jusqu’à l’état fondamental en une seule fois,ou s’arrêter en chemin à un niveau intermédiaire.
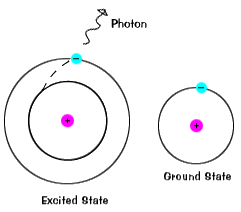 |
les électrons ne restent pas très longtemps dans des états excités – ils retournent bientôt à leurs états fondamentaux, émettant un photon avec la même énergie que celui qui a été absorbé., |
identification des types individuels d’atomes
Les Transitions entre les différentes orbitales sont uniques pour chaque élément car les niveaux d’énergie sont déterminés de manière unique par les protons et les neutrons dans le thénucléus. Nous savons que différents éléments ont des nombres différents deprotons et neutrons dans leurs noyaux. Lorsque les électrons d’un certain atome reviennent à des orbitales inférieures à partir d’états excités, les photons qu’ils émettent ont des énergies caractéristiques de ce type d’atome., Cela donne à chaque élément une empreinte digitale unique, permettant d’identifier les éléments présents dans un récipient de gaz, voire une étoile.
Nous pouvons utiliser des outils comme le tableau périodique des éléments pour comprendre exactement combien de protons, et donc d’électrons, un atome A. Tout d’abord, nous savonsque pour qu’un atome ait une charge neutre, il doit avoir le même nombre deprotons et d’électrons. Si un atome perd ou gagne des électrons, Il devientsionisé ou chargé. Le tableau périodique nous donnera le numéro atomiqueun élément. Le numéro atomique nous dit combien de protons un atomea., Par exemple, l’hydrogène a un numéro atomique de Un-ce qui signifie qu’il aun proton, et donc un électron – et n’a pas de neutrons.
Pour les Étudiants
sur la Base de la description précédente de l’atome, tirage unmodèle de l’atome d’hydrogène. Le modèle » standard » d’un atome est connucomme le modèle de Bohr.
différentes formes d’un même élément chimique qui ne diffèrent que par le nombre de neutrons dans leur noyau sont appelées isotopes. La plupart des éléments ontplus d’un isotope naturel., Beaucoup plus d’isotopes ont étéproduit dans les réacteurs nucléaires et les laboratoires scientifiques. Les Isotopes ne sont généralement pas très stables, et ils ont tendance à subir une désintégration radioactive jusqu’à ce que quelque chose de plus stable se forme. Vous connaissez peut – être l’élémenturanium-il a plusieurs isotopes instables, U-235 étant l’un des pluscommonly connu. Le 235 signifie que cette forme d’uranium a 235 neutronset protons combinés. Si nous recherchions le numéro atomique de l’uranium, et soustrait celui de 235, nous pourrions calculer le nombre de neutrons que l’isotope A.,
Voici un autre exemple – le carbone se présente généralement sous la forme de C-12 (carbone-12), c’est-à-dire 6 protons et 6 neutrons, bien qu’un isotope soit C-13, avec 6protons et 7 neutrons.
Pour les Étudiants
Utiliser le tableau périodique, et les noms des éléments donnés ci-dessous pour trouver le nombre de protons, de neutrons et d’électrons qu’ils ont.Dessinez un modèle d’un atome de l’élément suivant: silicium-28,magnésium-24, soufre-32, oxygène-16 et hélium-4.,
pour L’étudiant
à l’aide du texte, définissez les termes suivants: niveaux d’énergie, absorption, émission, état excité, état fondamental, ionisation,atome, élément, masse atomique, numéro atomique, isotope.
une Note facultative sur la nature mécanique quantique des atomesalors que L’atome de Bohr décrit ci-dessus est un bon moyen d’en apprendre davantage sur la structure des atomes, ce n’est pas le moyen le plus précis de les modéliser., bien que chaque orbitale ait une énergie précise, l’électronique est maintenant envisagée comme étant étalée dans un « nuage d’électrons »entourant le noyau. Il est courant de parler de la distance moyenne au nuage comme le rayon de l’électron orbit.So rappelez-vous, nous garderons les mots « orbite » et « orbitale », bien que nous les utilisions maintenant pour décrire non pas un plan orbital plat, mais un espace où un électron a une probabilité d’être. Les électrons sont maintenus près de thenucleus par l’attraction électrique entre le noyau et les électrons.,Gardé là de la même manière que les neuf planètes restent près du soleil au lieu deroaming la galaxie. Contrairement au système solaire, où toutes les orbites des planetsont sur le même plan, les orbites des électrons sont plus tridimensionnelles. Chaquele niveau d’énergie sur un atome a une forme différente. Il existe des équations mathématiques qui vous indiqueront la probabilité de l’emplacement de l’électron dans cette orbite. considérons l’atome d’hydrogène, dont nous avons déjà dessiné un modèle de Bohr.,
le texte et les images de cette section ont été adaptés de la page de Dave Slaven sur L’atome (voir les références ci-dessous). |

