un bref résumé du procédé Haber
Le procédé Haber combine l’azote de l’air avec l’hydrogène provenant principalement du gaz naturel (méthane) en ammoniac. La réaction est réversible et la production d’ammoniac est exothermique.,
![]()
![]()
Un schéma des flux pour le Processus de Haber ressemble à ceci:
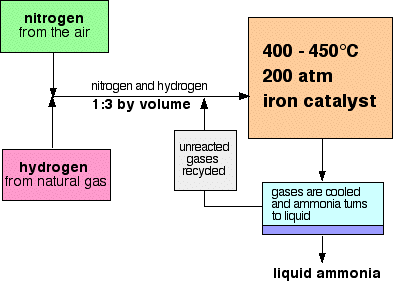
Quelques remarques sur les conditions
Le catalyseur
Le catalyseur est légèrement plus compliqué que le fer pur. Il y a de l’hydroxyde de potassium ajouté en tant que promoteur – une substance qui augmente son efficacité.
la pression
la pression varie d’une usine à l’autre, mais est toujours élevée. Vous ne pouvez pas vous tromper dans un examen citant 200 atmosphères.,
recyclage
à chaque passage des gaz dans le réacteur, seulement environ 15% de l’azote et de l’hydrogène se transforment en ammoniac. (Ce chiffre varie d’une plante à l’autre.) Par recyclage continu de l’azote et de l’hydrogène qui n’ont pas réagi, la conversion globale est d’environ 98%.
Expliquant les conditions
Les proportions d’azote et d’hydrogène
Le mélange d’azote et d’hydrogène va dans le réacteur est dans la proportion de 1 volume d’azote à 3 volumes d’hydrogène.,
la loi D’Avogadro dit que des volumes égaux de gaz à la même température et pression contiennent un nombre égal de molécules. Cela signifie que les gaz vont dans le réacteur dans le rapport de 1 molécule d’azote à 3 de l’hydrogène.
C’est la proportion exigée par l’équation.
Dans certaines réactions que vous pourriez choisir d’utiliser un excès d’un des réactifs. Vous feriez cela s’il est particulièrement important d’utiliser autant que possible l’autre réactif – si, par exemple, il était beaucoup plus cher. Ça ne s’applique pas dans ce cas.,
Il y a toujours un inconvénient à utiliser autre chose que les proportions de l’équation. Si vous avez un excès d’un réactif, il y aura des molécules qui passeront à travers le réacteur et qui ne pourront pas réagir car il n’y a rien avec lequel elles puissent réagir. Cela gaspille l’espace du réacteur-en particulier l’espace à la surface du catalyseur.
la température
considérations D’équilibre
Vous devez déplacer la position de l’équilibre autant que possible vers la droite afin de produire la quantité maximale possible d’ammoniac dans le mélange d’équilibre.,
la réaction vers l’avant (production d’ammoniac) est exothermique.
![]()
![]()
Selon Le Chatelier Principe, ce sera favorisée si vous baissez la température. Le système réagira en déplaçant la position d’équilibre pour contrer cela – en d’autres termes en produisant plus de chaleur.
pour obtenir autant d’ammoniac que possible dans le mélange d’équilibre, vous avez besoin d’une température aussi basse que possible. Cependant, 400-450°C n’est pas une basse température!,
considérations de taux
plus la température que vous utilisez est basse, plus la réaction devient lente. Un fabricant essaie de produire autant d’ammoniac que possible par jour. Cela n’a aucun sens d’essayer d’obtenir un mélange d’équilibre contenant une très forte proportion d’ammoniac s’il faut plusieurs années pour que la réaction atteigne cet équilibre.
Vous avez besoin que les gaz atteignent l’équilibre dans le temps très court qu’ils seront en contact avec le catalyseur dans le réacteur.,
le compromis
400 – 450°c est une température de compromis produisant une proportion raisonnablement élevée d’ammoniac dans le mélange d’équilibre (même si elle n’est que de 15%), mais en très peu de temps.
pression
l’Équilibre des considérations
![]()
![]()
Notez qu’il y a 4 molécules sur le côté gauche de l’équation, mais seulement 2 sur la droite.,
selon le principe de Le Chatelier, si vous augmentez la pression, le système réagira en favorisant la réaction qui produit moins de molécules. Qui sera la cause de la pression à tomber de nouveau.
pour obtenir autant d’ammoniac que possible dans le mélange d’équilibre, vous avez besoin d’une pression aussi élevée que possible. 200 atmosphères est une pression élevée, mais pas incroyablement élevée.
considérations de taux
L’augmentation de la pression rapproche les molécules., Dans ce cas particulier, cela augmentera leurs chances de frapper et de coller à la surface du catalyseur où ils peuvent réagir. Plus la pression est élevée mieux en termes de taux d’un gaz de réaction.
considérations économiques
Les très hautes pressions sont très coûteuses à produire pour deux raisons.
Vous devez construire des tuyaux et des récipients de confinement extrêmement solides pour résister à la très haute pression. Cela augmente vos coûts en capital lorsque l’usine est construite.
Les Hautes Pressions coûtent cher à produire et à entretenir., Cela signifie que les coûts de fonctionnement de votre installation sont très élevés.
Le compromis
200 atmosphères est un compromis pression choisie pour des raisons économiques. Si la pression utilisée est trop élevée, le coût de sa production dépasse le prix que vous pouvez obtenir pour l’ammoniac supplémentaire produit.
Le catalyseur
l’Équilibre des considérations
Le catalyseur n’a aucun effet sur la position de l’équilibre. L’ajout d’un catalyseur ne produit pas un plus grand pourcentage d’ammoniac dans le mélange d’équilibre. Sa seule fonction est d’accélérer la réaction.,
Considérations relatives à la vitesse
En l’absence d’un catalyseur, la réaction est si lente que pratiquement aucune réaction ne se produit en un temps raisonnable. Le catalyseur garantit que la réaction est suffisamment rapide pour qu’un équilibre dynamique soit mis en place dans le temps très court que les gaz sont réellement dans le réacteur.
la Séparation de l’ammoniac
Lorsque le gaz laisser le réacteur, ils sont chauds et très haute pression., L’ammoniac est facilement liquéfié sous pression tant qu’il ne fait pas trop chaud, et donc la température du mélange est suffisamment abaissée pour que l’ammoniac se transforme en liquide. L’azote et l’hydrogène restent des gaz, même sous ces hautes pressions, et peuvent être recyclés.
les Questions pour tester votre compréhension
Si c’est la première série de questions que vous avez fait, merci de lire la page d’introduction avant de commencer. Vous devrez utiliser le bouton Retour de votre navigateur pour revenir ici par la suite.,
les questions sur le Processus de Haber
réponses
Où aimeriez-vous aller maintenant?
vers le menu equilibrium . . .
Au menu de Chimie Physique . . .
Au Menu Principal . . .