Introduction
pendant l’hiver, les dermatologues reçoivent parfois des patients asymptomatiques, sans lésions spécifiques autres que, peut-être, une décoloration post-inflammatoire, mais avec un besoin désespéré d’aide. Ils commencent à raconter l’histoire d’un certain nombre de papules ou vésicules apparaissant sur leur peau après la première exposition intense au soleil de l’année., Avec les lésions, une terrible démangeaison commence et augmente avec la propagation de la maladie, après la prochaine exposition au soleil, parfois aggravée par une sorte de sensation de brûlure. Néanmoins, ce peuple est un modèle de chercheurs de soleil et continue de profiter du soleil tout au long de l’été, en attendant que les papules s’estompent et disparaissent progressivement. Les principales questions sont: comment puis-je empêcher cela? Pourquoi j’ai ce problème depuis « 5 » ans maintenant, mais je ne l’ai jamais eu auparavant?,
Nous avons très probablement affaire à une éruption lumineuse polymorphe (PLE) et, suite aux demandes de nos patients, la recherche médicale s’est principalement concentrée sur des stratégies de prévention devenues aujourd’hui tout à fait satisfaisantes. De l’autre côté, la deuxième question et certainement moins explorée reste floue, à moins que plusieurs pièces n’aient été ajoutées à ce puzzle plutôt compliqué. Le but de cette brève revue est de reprendre les avancées les plus récentes dans les mécanismes possibles de PLE et les protocoles les plus utilisés pour la prévention ou le traitement.
Pathophisiologie de L’Éruption lumineuse polymorphe: Quoi de neuf?,
Le PLE est le trouble photosensible le plus courant, caractérisé par une éruption intermittente de papules, vésicules ou plaques érythémateuses prurigineuses non cicatrisantes (Figure 1) qui se développent dans les heures suivant l’exposition aux rayons ultraviolets (UV) de la peau du patient. La maladie dépend de la susceptibilité génétique, ainsi que sur l’environnement, telles que le type d’exposition. Le PLE semble se regrouper dans les familles: il a été estimé que la prévalence du PLE était de 21 et 18% chez les jumeaux monozygotes et dizygotes, respectivement (1)., De plus, 12% des couples de jumeaux affectés par rapport à 4% des couples de jumeaux non affectés présentaient des antécédents familiaux positifs d’ELP chez les parents du premier degré (p < 0,0001). La concordance probandwise chez les monozygotes était supérieure à celle des paires de jumeaux dizygotes (0,72 contre 0,30, respectivement), démontrant un fort effet génétique (1). De nombreux gènes présentant un intérêt potentiel pour la pathogenèse du PLE ont été étudiés avec des résultats généralement peu gratifiants., En utilisant l’analyse de ségrégation, il a été estimé que 72% de la population du Royaume-Uni porte un allèle de sensibilité à la pénétrance faible (2).
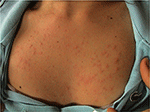
la Figure 1. Tableau clinique de l’Éruption lumineuse polymorphe chez une jeune femme.
L’échec de L’apoptose: les possibles antigènes néo Photo-induits
dans une analyse récente de l’expression à l’échelle du génome, seulement 16 gènes ont été exprimés de manière différentielle entre les témoins PLE et les témoins sains après irradiation UV par rapport au témoin (3)., Parmi ces gènes, 14 ont montré une expression plus faible chez les patients atteints de DEL, tandis que deux ont été surexprimés. Parmi les 14 gènes dont l’expression est plus faible dans PLE figurent: la sous-unité du complément 1S (C1s), la fibronectine du récepteur B1 (SCARB1) (FN1), le membre de la superfamille des immunoglobulines 3 (IGSF3), la caspase-1 (CASP1) et la paraoxonase 2 (PON2), tous des gènes associés à la clairance des cellules apoptotiques. On a supposé que la modification des protéines au cours de la clairance des cellules apoptotiques pourrait conduire à la formation potentielle d’auto-antigènes (4)., Ensuite, l’expression réduite chez les patients PLE de gènes liés à ce processus pourrait représenter une source d’auto-antigène possible, ainsi qu’une phase cruciale dans l’initiation du processus auto-immun qui favorise la maladie (3). Conformément à ces conclusions, Kuhn et al. a montré une accumulation de cellules apoptotiques chez les patients atteints de DEL irradiés soit avec 1,5 dose minimale D’érythème (MED) D’UVB, soit 60-100 J/cm2 D’UVA1, par rapport aux témoins (5).,
immunité: échec de la tolérance
Les auto-antigènes issus de la clairance inefficace des cellules apoptotiques, sont probablement repris par les cellules dendritiques (DCs) et présentés aux lymphocytes T naïfs (cytotoxiques et auxiliaires) transformés ensuite en lymphocytes T auto-réactifs (6, 7). Cet échec partiel de l’apoptose contribue, avec l’immunosuppression inadéquate après exposition aux UV, à la reconnaissance et à la présentation de l’antigène, conduisant à la manifestation clinique typique des patients atteints de DEL (8)., En effet, l’échec de l’immunosuppression normale induite par les rayons UV a été prouvé comme la principale anomalie immunologique dans PLE, expliquée, dans un premier temps, par la permanence des cellules de Langerhans (LCS) dans l’épiderme. Cette suractivation du système immunitaire, qui échappe à la tolérance fonctionnelle induite par les UV, est probablement responsable de la diminution de la prévalence du cancer de la peau chez les patients atteints de DEL (9). D’autre part, le même mécanisme est coupable de l’échec de la suppression de la dermatite de contact allergique (DCA), après exposition aux rayons UV (10).,
voie inflammatoire: réaction D’hypersensibilité de type retardé
Les mécanismes immunologiques impliqués dans la PLE, avec des médiateurs du système immunitaire inné et adaptatif, sont très similaires, du point de vue histologique ou biochimique, à ceux de L’ACD. En effet, au début des années soixante-dix, Epstein a d’abord indiqué PLE comme une réaction d’hypersensibilité de type retardé (DTHR) à un antigène cutané induite par les rayons UV non défini (11). Récemment, pour renforcer ce concept, certains des médiateurs inflammatoires impliqués dans ACD ont été démontrés également dans PLE., Par exemple, la famille IL-1 (12, 13), un groupe croissant de cytokines qui jouent plusieurs rôles dans la régulation immunitaire et l’inflammation (14), impliquée également dans la pathogenèse de L’ACD (12, 15), a été explorée également dans PLE (16). IL – 36α et il-36γ, les membres pro-inflammatoires de la famille IL-1 ont été augmentés en PLE par rapport aux témoins, comme pour les échantillons ACD, mais IL-36γ a été beaucoup plus élevé en PLE que dans ACD (16). Agissant par le récepteur commun composé D’IL – 36R et D’il-1R/AcP (il-1rl2), il-36α, IL-36β, et il-36γ activent le NF-kB et les MAPKs, favorisant des réactions inflammatoires., L’augmentation de L’IL – 36s dans la peau et le sang périphérique des patients PLE indique l’activation de la réponse immunitaire locale et systémique, comme on le trouve dans de multiples affections inflammatoires de la peau (15, 17, 18). Probablement, le lien entre L’IL – 36s et L’exposition aux rayons UV est représenté par le signal pro-inflammatoire paracrine de l’activation du récepteur toll like (TLR)-3, dû à la libération d’ARN par les kératinocytes nécrotiques (19). En effet, l’échec de la clairance apoptotique en PLE, avec abondance de débris cellulaires, pourrait être responsable d’une amplification de ce « signal d’alerte., »
de plus, L’IL-36s pourrait contribuer à amplifier le signal immunitaire inné et la cascade inflammatoire qui en résulte, en favorisant les peptides antimicrobiens (amp) (20).
voie inflammatoire: ampères et Microbiome
comme largement examinés dans de multiples processus inflammatoires cutanés, ces médiateurs, nommés défensines (α Et β), cathélicidine (LL37), ribonucléase 7 (RNase7) et psoriasine (S100A7), à la lumière du déséquilibre induit par les rayons UV sur les kératinocytes et le microbiome cutané, ont également été étudiés dans PLE (21, 22). Patra et coll., ont constaté que l’expression de psoriasin, RNase7, HBD-2, et LL-37 a été augmentée dans la peau lle lésionnelle, alors que HBD-3 a été diminué. Considérant la surface de la peau comme un « monde multiethnique », sans oublier le rôle crucial des kératinocytes, nous ne pouvons pas exclure que la libération D’ampères puisse être déterminée par la modification des composants du microbiome après interaction UV (23). En effet, le microbiome pourrait représenter la source, directe ou indirecte, des antigènes induits par les rayons UV encore non détectés formés chez les patients atteints de PLE, conduisant à des lésions kératinocytaires., En conséquence, LL-37, également induit par UVB, IFNy, TNF-α, IL-6, pourrait représenter un potentiel facteur indirect de PLE (23). Il peut former des agrégats avec des acides auto-nucléiques capables d’activer les pDCs: dans le psoriasis, il a été reconnu comme l’autoantigène principal (24). Même si chez les patients atteints de DEL, une absence totale de pDCs a été rapportée (25), Il existe un milieu auto-immun et la LL-37 pourrait jouer un rôle central, induisant d’autres voies inflammatoires. Dans la Figure S1 (matériel supplémentaire), les concepts exprimés ci-dessus sont visualisés dans un dessin animé.
thérapie de L’Éruption lumineuse polymorphe: Quoi de neuf?,
la première ligne de traitement pour L’ELP comprend l’évitement du soleil, les écrans solaires et les corticostéroïdes topiques (26). Pour tous les patients, la prise en charge préventive est fondamentale par temps ensoleillé, en évitant l’exposition intense aux rayons UV et l’utilisation de vêtements de protection, ainsi que l’application d’un écran solaire, en particulier lors de la première exposition de l’année. Il a été rapporté que les écrans solaires à large spectre de nouvelle génération, avec un facteur de protection solaire élevé pour les UVB (SPF), ainsi qu’une protection UVA à plus longue longueur d’onde, confèrent une protection totale ou partielle chez jusqu’à 90% des patients atteints de DEL (27, 28)., L’utilisation d’antioxydants oraux et de nicotinamide pourrait représenter une mesure préventive supplémentaire valable pour ces patients. Les effets bénéfiques du nicotinamide ont été étudiés dans un essai non contrôlé de 42 patients, où 60% d’entre eux ont signalé une abolition complète des symptômes lors de la prise de 2 à 3 g de nicotinamide par jour, avant l’exposition au soleil (29). De plus, il a été démontré qu’un extrait de Polypodiumleucotomos [PL) de fougère tropicale exerce à la fois de puissants effets antioxydants et immunomodulateurs., Lorsqu’il est administré à 480 mg / jour avant l’exposition au soleil, il réduit considérablement les réactions cutanées et les symptômes subjectifs (30, 31). En ce qui concerne les corticostéroïdes topiques, même si aucun essai n’a été effectué pour déterminer leur efficacité dans les DEL, ils sont largement utilisés pour réduire les démangeaisons (26). La deuxième gamme de traitements pour les DEL comprend les corticostéroïdes systémiques et la photothérapie(chimio) (26). Dans un essai randomisé, en double aveugle, contrôlé par placebo (32), Les auteurs ont suggéré l’utilisation de 25 mg de prednisolone par jour pendant 4 à 5 jours au début de l’Éruption., Bien que, les effets secondaires potentiels à long terme des cours répétés de prednisolone doivent être considérés, il pourrait être conseillé pour les patients qui souffrent d’attaques occasionnelles de PLE, en l’absence de contre-indications. Dans les cas plus légers de DEL, un programme d’auto-conditionnement par l’exposition des diplômés à la lumière du soleil au printemps peut suffire (33). Alors que, dans les cas plus graves, un traitement de conditionnement/désensibilisation sous surveillance médicale peut être plus approprié., Un traitement au psoralène et aux UVA (PUVA), à bande étroite (NB)-UVB ou à large bande (BB)-UVB, généralement administré au début du printemps, peut être efficace ainsi qu’un traitement prophylactique (26). Le protocole de traitement consiste généralement en un cours de photothérapie/photochimiothérapie sur 5-6 semaines. Les doses initiales dépendent de la dose érythémale minimale (MED) ou de la dose phototoxique minimale (MPD), et sont fréquemment de 50 à 70% de ces seuils mesurés avec des augmentations progressives., Pour maintenir le bénéfice acquis avec la thérapie désensibilisante, une exposition régulière au soleil tout au long de l’été est conseillée, sinon le durcissement pourrait être perdu dans les 4-6 semaines. Dans le traitement de PLE, NB-UVB devrait être préféré à PUVA (force de recommandation D; niveau de preuve 4), en raison du risque plus faible de photocarcinogenèse, aucun risque de nausée ou d’autres effets secondaires associés à l’ingestion de MOP, et aucun besoin d’utiliser une protection oculaire post-traitement. Cependant, la PUVA doit être envisagée, avant d’autres traitements systémiques, si le NB-UVB a échoué ou a déjà déclenché l’Éruption., En effet, comme décrit ci-dessous, l’efficacité a été prouvée pour les régimes multiples de photothérapie (BB-UVB, NB-UVB et PUVA), et les effets secondaires, en termes de provocation d’éruption cutanée, d’érythème et de démangeaison se sont avérés plus fréquents avec les UVB qu’avec les PUVA (34). Comme résumé, dans la littérature, l’efficacité du PUVA se traduit par un taux de photoprotection de 65 à 100% (34)., Plusieurs études comparatives ont été réalisées, mais à partir du seul essai contrôlé randomisé entre PUVA et NB-UVB plus comprimés placebo, trois fois par semaine, pendant 5 semaines, aucune différence significative dans l’efficacité n’a émergé, compte tenu de l’apparition de la PLE ou de la restriction de l’activité extérieure (35). Dans la revue rétrospective des années 10, rapportée par Man et al. (36), 170 patients présentant une EMP modérée à sévère ont reçu de la PUVA et/ou une photothérapie UVB. En détail, 8 patients ont reçu du PUVA, 128 NB-UVB, 5 BB-UVB et 29 patients, qui n’ont pas répondu de manière satisfaisante au NB-UVB, ont reçu du PUVA l’année suivante., Des autoévaluations ont été faites de la gravité et la fréquence des épisodes D’ELP a été signalée lors des visites de suivi à l’automne ou au printemps suivant. Une amélioration bonne ou modérée a été rapportée chez 88% des patients traités par PUVA et chez 89% des patients traités par UVB. Parmi les patients traités à la fois par PUVA et NB-UVB, la majorité a préféré le PUVA. Dans une autre étude rétrospective de 14 ans sur 79 patients traités par photothérapie (37), l’efficacité, mesurée au cours de l’été suivant en termes de photoprotection avec rémission complète/partielle, était de 65% pour les PUVA, 82% pour les BB-UVB et 83% pour les UVA seuls., Dans ce cas, le traitement par PUVA a été réservé aux formes de PLE plus sévères.
Les mécanismes par lesquels la photothérapie induit la photoprotection ne sont pas entièrement compris.
Cependant, dans les dernières années, de nombreuses avancées ont été réalisées. En plus des effets bien connus sur la mélaninisation et l’épaississement épidermique de la photothérapie, un large éventail de propriétés immunomodulatrices et anti-inflammatoires induites par les UV sont rapportées (38)., Les UVB et les UVA modulent l’expression des molécules d’adhésion et induisent des médiateurs solubles, tels que l’hormone stimulant les mélanocytes a, L’il-10 (qui supprime la production d’interféron γ) et la prostaglandine E2, qui expliquent les actions anti-inflammatoires, empêchant l’activation des lymphocytes T et favorisant l’apoptose des lymphocytes T infiltrants cutanés (34). De plus, il a été démontré que le photohardening UV prophylactique chez les patients atteints de PLE restaure la migration de LC induite par les UV de l’épiderme vers les ganglions lymphatiques drainant la peau: l’un des événements cellulaires clés de l’immunosuppression UV (39)., La tolérance induite par la LC est médiée par la libération de cytokines immunosuppressives telles que L’IL-10, et par l’interférence avec la maturation et l’induction des lymphocytes T régulateurs (Tregs) (40). De plus, récemment, un lien intéressant a été signalé entre la LC, Les Tregs et la vitamine D3. En effet, il a été démontré qu’un prétraitement topique à court terme de 1 semaine avec l’analogue de la 1,25-dihydroxyvitamine D, le calcipotriol, diminuait les symptômes de PLE après une photoprovocation expérimentale ultérieure (41)., En outre, dans une étude murine, la 1,25-dihydroxyvitamine D a montré des effets immunosuppresseurs comparables à ceux des UV (42). Une autre diaphonie intéressante a été mise en évidence entre les LCs et les mastocytes. En plus de leur rôle reconnu dans l’atopie, les mastocytes dermiques sont également responsables de la protection de la peau contre l’inflammation induite par les UVB, favorisant l’immunosuppression UV (40). Des études humaines ont démontré qu’après une exposition aiguë et chronique aux rayons UV, le nombre de mastocytes dermiques augmente, avec la libération d’IL-10., Dans l’ensemble, ces données suggèrent un rôle potentiel pour les mastocytes dans le PLE et dans le mécanisme de photohardening. Conformément à cela, Wolf et al. ont rapporté, pour la première fois, que le photohardissement augmente significativement la densité des mastocytes dans le derme papillaire des patients atteints de PLE (40). En résumé, le photohardening fonctionne dans PLE en restaurant la voie immuno-suppressive UV normale, impliquant plusieurs types de cellules. Le traitement de troisième ligne pour PLE comprend l’utilisation de médicaments immunosuppresseurs systémiques, tels que l’azathioprine et la cyclosporine., Cependant, seuls des cas sporadiques de patients traités avec succès sont rapportés dans la littérature (43, 44). De plus, l’hydroxychloroquine, les acides gras oméga-3 et le bêta-carotène ont été proposés comme traitements, mais d’autres essais contrôlés randomisés en double aveugle pour évaluer réellement leur efficacité clinique sont nécessaires.
Conclusions
compte tenu de la prévalence élevée et de l’incidence croissante des DEL, associées à l’inconfort et aux restrictions du style de vie, des études futures sont nécessaires pour trouver de nouvelles stratégies thérapeutiques et / ou préventives., Le choix du traitement PLE approprié nécessite une bonne connaissance de l’évolution clinique individuelle de la maladie ainsi que la possibilité d’effectuer un phototest. Certains nouveaux aspects de l’activation et de la promotion possibles du processus inflammatoire ont été mis en évidence.,
dans l’état actuel des connaissances, malgré l’identification d’une régulation cellulaire cruciale impliquée dans le rétablissement de la tolérance immunitaire, il est difficile de tirer des conclusions définitives sur l’efficacité de divers traitements potentiels dans le PLE, en raison du manque d’études adéquates et de la difficulté à évaluer les mesures des résultats. Le score clinique pour évaluer la sévérité de L’EPL (PLESI) (45) reste un instrument peu utilisé et principalement limité à des fins de recherche., L’étude plus approfondie des mécanismes pathogéniques sous-jacents du trouble permettra une approche thérapeutique plus ciblée.
contributions de L’auteur
SL a projeté le manuscrit, sélectionné le matériel pour l’article, écrit le brouillon initial et corrigé les brouillons suivants du manuscrit. AR était engagé dans l’écriture du manuscrit, soutenant de nouvelles idées de contenu et de style.,
déclaration de conflit d’intérêts
Les auteurs déclarent que la recherche a été menée en l’absence de toute relation commerciale ou financière pouvant être interprétée comme un conflit d’intérêts potentiel.
Matériel Supplémentaire
la Figure S1. Interaction entre le système immunitaire inné et adaptatif dans un contexte d’échec de l’apoptose dans l’épiderme. (Symbole vert) Psoriasine: expression abondante dans les couches épineuses et granulaires de la peau PLE. (Symbole bleu) RNase7: principalement exprimé dans les kératinocytes de la couche granulosum et de la couche cornée des lésions PLE., (Symbole jaune) LL-37 a été profondément exprimé dans et autour des vaisseaux sanguins et des glandes dans PLE. (Symbole cellulaire Violet) kératinocytes apoptotiques avec clairance inefficace.,hic light eruption; ACD, Allergic contact dermatitis; DTHR, Delayed type hypersensitivity reaction; UVR, Ultraviolet radiation; C1s, Complement 1s subunit; SCARB1, Scavenger receptor B1; FN1, Fibronectin; IGSF3, Immunoglobulin superfamily member 3; CASP1, Caspase-1; PON2, Paraoxonase 2; MED, Minimal Erythema Dose; DCs, Dendritic cells; LCs, Langerhans cells; TLR, Toll like receptor; AMPs, Antimicrobial peptides; SPF, Sun protection factor; PUVA, Psoralen and UVA therapy; NB-UVB, Narrowband; BB-UVB, Broadband UVB; MPD, Minimum phototoxic dose; Tregs, Regulatory T cells; PL, Polypodiumleucotomos.,
2. McGregor JM, Grabczynska S, Vaughan R, Hawk JL, Lewis CM. Genetic modelling of abnormal photosensitivity in families with polymorphic light eruption and actinic prurigo. J Invest Dermatol. (2000) 115:471–6. doi: 10.1046/j.1523-1747.2000.00080.x
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Lembo S, Hawk JLM, Murphy GM, Kaneko K, Young AR, McGregor JM, et al., Aberrant gene expression with deficient apoptotic keratinocyte clearance may predispose to polymorphic light eruption. Br J Dermatol. (2017) 177:1450–3. doi: 10.1111/bjd.15200
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Savill J, Fadok V. Corpse clearance defines the meaning of cell death. Nature (2000) 407:784–8. doi: 10.,1038/35037722
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Kuhn A, Herrmann M, Kleber S, Beckmann-Welle M, Fehsel K, Martin-Villalba A, et al. Accumulation of apoptotic cells in the epidermis of patients with cutaneous lupus erythematosus after ultraviolet irradiation. Arthritis Rheum. (2006) 54:939–50. doi: 10.1002/art.21658
PubMed Abstract | CrossRef Full Text | Google Scholar
6., Savill J, Dransfield I, Gregory C, Haslett C. A blast from the past: clearance of apoptotic cells regulates immune responses. Nat RevImmunol. (2002) 2:965–75. doi: 10.1038/nri957
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Albert ML, Sauter B, Bhardwaj N. Dendritic cells acquire antigen from apoptotic cells and induce class I-restricted CTLs. Nature (1998) 392:86–9. doi: 10.,1038/32183
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Koulu LM, Laihia JK, Peltoniemi HH, Jansén CT. UV-induced tolerance to a contact allergen is impaired in polymorphic light eruption. J Invest Dermatol. (2010) 130:2578–82. doi: 10.1038/jid.2010.181
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Epstein JH. Polymorphous light eruption. J Am Acad Dermatol. (1980) 3:329–43.,
PubMed Abstract | Google Scholar
12. Mattii M, Ayala F, Balato N, Filotico R, Lembo S, Schiattarella M, et al. The balance between pro- and anti-inflammatory cytokines is crucial in human allergic contact dermatitis pathogenesis: the role of IL-1 family members. Exp Dermatol. (2013) 22:813–9. doi: 10.1111/exd.12272
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Dinarello CA., Interleukine – 1 dans la pathogenèse et le traitement des maladies inflammatoires. Sang (2011) 117:3720-32. doi: 10.1182/sang-2010-07-273417
PubMed Abstract | CrossRef Texte Intégral | Google Scholar
16. Lembo S, Caiazzo G, Balato N, Monfrecola G, Patra V, Wolf P, et al. Éruption de lumière polymorphe et membres de la famille IL-1: une différence avec la dermatite de contact allergique? Photochem Photobiol Sci. (2017) 16:1471–9. doi: 10.,1039/c7pp00142h
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Balato A, Schiattarella M, Lembo S, Mattii M, Prevete N, Balato N, et al. Interleukin-1 family members are enhanced in psoriasis and suppressed by vitamin D and retinoic acid. Arch Dermatol Res. (2013) 305:255–62. doi: 10.1007/s00403-013-1327-8
PubMed Abstract | CrossRef Full Text | Google Scholar
19., Il s’agit d’un groupe de travail composé de membres de la communauté de communes du pays de Montauban et de membres de la communauté de communes du pays de Montauban. L’activation du récepteur Toll-like 3 est nécessaire pour la réparation normale de la barrière cutanée après les dommages causés par les UV. J. Investir Dermatol. (2015) 135:569–78. doi: 10.1038 / jid.2014.354
PubMed Abstract | CrossRef Texte Intégral | Google Scholar
20. Li N, Yamasaki K, Saito R, Fukushi-Takahashi s, Shimada-Omori R, Asano M, et al. Alarmin fonction de cathelicidin peptide antimicrobien LL37 par induction IL – 36γ dans les kératinocytes épidermiques humains. J Immunol., (2014) 193:5140–8. doi: 10.4049/jimmunol.1302574
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Patra V, Wolf P. Microbial elements as the initial triggers in the pathogenesis of polymorphic light eruption? Exp Dermatol. (2016) 25:999–1001. doi: 10.1111/exd.13162
PubMed Abstract | CrossRef Full Text | Google Scholar
22., Gläser R, Navid F, Schuller W, Jantschitsch C, Harder J, Schröder JM, et coll. Le rayonnement UV-B induit l’expression de peptides antimicrobiens dans les kératinocytes humains in vitro et in vivo. J Allergie Clin Immunol. (2009) 123:1117–23. doi: 10.1016/j.jaci.2009.01.043
PubMed Abstract | CrossRef Texte Intégral | Google Scholar
23. Patra V, Mayer G, Gruber-Wackernagel Un, Corne M, Lembo S, Loup P., Profil Unique de l’expression des peptides antimicrobiens dans les lésions d’éruption de lumière polymorphes par rapport à une peau saine, à la dermatite atopique et au psoriasis. Photodermatol Photoimmunol Photomed. (2018) 34:137–44. doi: 10.1111 / phpp.12355
PubMed Abstract | CrossRef Texte Intégral | Google Scholar
25. Schweintzger NA, Gruber-Wackernagel A, Shirsath N, Quehenberger F, Obermayer-Pietsch B, Wolf P. Influence des saisons sur les niveaux de vitamine D et les cellules T régulatrices chez les patients présentant une éruption lumineuse polymorphe., Photochem Photobiol Sci. (2016) 15:440–6. doi: 10.1039/c5pp00398a
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Proby C, Baker C, Morton O, Hawk JLM. New broad spectrum sunscreen for polymorphic light eruption. Lancet (1993) 341:1347–8.
PubMed Abstract | Google Scholar
28. Allas S, Lui H, Moyal D, Bissonnette R., Comparaison de la capacité de 2 écrans solaires à protéger contre l’éruption de lumière polymorphe induite par une lampe aux halogénures métalliques UV-A/UV-B. Arch Dermatol. (1999) 135:1421–2.
PubMed Abstract | Google Scholar
29. Ortel B, Wechdorn D, Tanew Un, Honigsmann H. l’Effet de la nicotinamide sur le phototest réaction dans polymorphe lighteruption. Br J Dermatol. (1988) 118:669–73.
PubMed Abstract | Google Scholar
30., Caccialanza M, Percivalle S, Piccinno R, Brambilla R. Photoprotective activity of oral Polypodiumleucotomos extract in 25 patients with idiopathic photodermatoses. Photodermatol Photoimmunol Photomed. (2007) 23:46–7. doi: 10.1111/j.1600-0781.2007.00274.x
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Tanew A, Radakovic S, Gonzalez S, Venturini M, Calzavara-Pinton P. Oral administration of a hydrophilic extract of Polypodiumleucotomos for the prevention of polymorphic light eruption., J Am Acad Dermatol. (2012) 66:58–62. doi: 10.1016/j.jaad.2010.09.773
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Van Praag MCG Boom, BW, Vermeer BJ. Diagnosis and treatment of polymorphous light eruption. Int J Dermatol. (1994) 33:233–9.
Google Scholar
34. Ling TC, Clayton TH, Crawley J, Exton LS, Goulden V, Ibbotson S, et al., L’association britannique des dermatologues et des britanniques photodermatology groupe de lignes directrices pour l’utilisation sûre et efficace de psoralène-ultraviolet Une thérapie 2015. Br J Dermatol. (2016) 174:24–55. doi: 10.1111 / bjd.14317
PubMed Abstract | CrossRef Texte Intégral | Google Scholar
36. Man I, Dawe RS, Ferguson J. durcissement artificiel pour éruption de lumière polymorphe: points pratiques de dix ans d’expérience. Photodermatol Photoimmunol Photomed. (1999) 15:3–4.,
PubMed Abstract | Google Scholar
37. Mastalier U, Kerl H, Wolf P. Clinical laboratory, phototest and phototherapy findings in polymorphic light eruptions: a retrospective study of 133 patients. Eur J Dermatol. (1998) 8:554–9.
PubMed Abstract | Google Scholar
38. Krutmann J, Morita A. Mechanisms of ultraviolet (UV) B and UVA phototherapy. J Invest Dermatol Symp Proc. (1999) 4:70–2.,
PubMed Abstract | Google Scholar
39. Janssens AS, Pavel S, Out-Luiting JJ, Willemze R, de Gruijl FR. Normalized ultraviolet (UV) induction of Langerhans cell depletion and neutrophil infiltrates after artificial UVB hardening of patients with polymorphic light eruption. Br J Dermatol. (2005) 152:1268–74. doi: 10.1111/j.1365-2133.2005.06690.x
PubMed Abstract | CrossRef Full Text | Google Scholar
40., Loup P, Gruber-Wackernagel A, Bambach j’, Schmidbauer U, Mayer G, Absenger M, et al. Le Photohardening des patients polymorphes d’Éruption légère diminue la densité épidermique de base de cellules de Langerhans tout en augmentant le nombre de mastocytes dans le derme papillaire. Exp Dermatol. (2014) 23:428–30. doi: 10.1111 / exd.12427
PubMed Abstract | CrossRef Texte Intégral | Google Scholar
42. Schwarz A, Navid F, Sparwasser T, Clausen BE, Schwarz T., 1,25-dihydroxyvitamin D exerts similar immunosuppressive effects as UVR but is dispensable for local UVR-induced immunosuppression. J Invest Dermatol. (2012) 132, 2762–9. doi: 10.1038/jid.2012.238
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Norris PG, Hawk JL. Successful treatment of severe polymorphous light eruption with azathioprine. Arch Dermatol. (1989) 125:1377–9.
PubMed Abstract | Google Scholar