objectifs D’apprentissage
- connaître les propriétés physiques des substances ioniques et moléculaires.
L’état physique et propriétés d’un composé particulier dépendent en grande partie du type de liaison chimique, qu’il affiche., Les composés moléculaires, parfois appelés 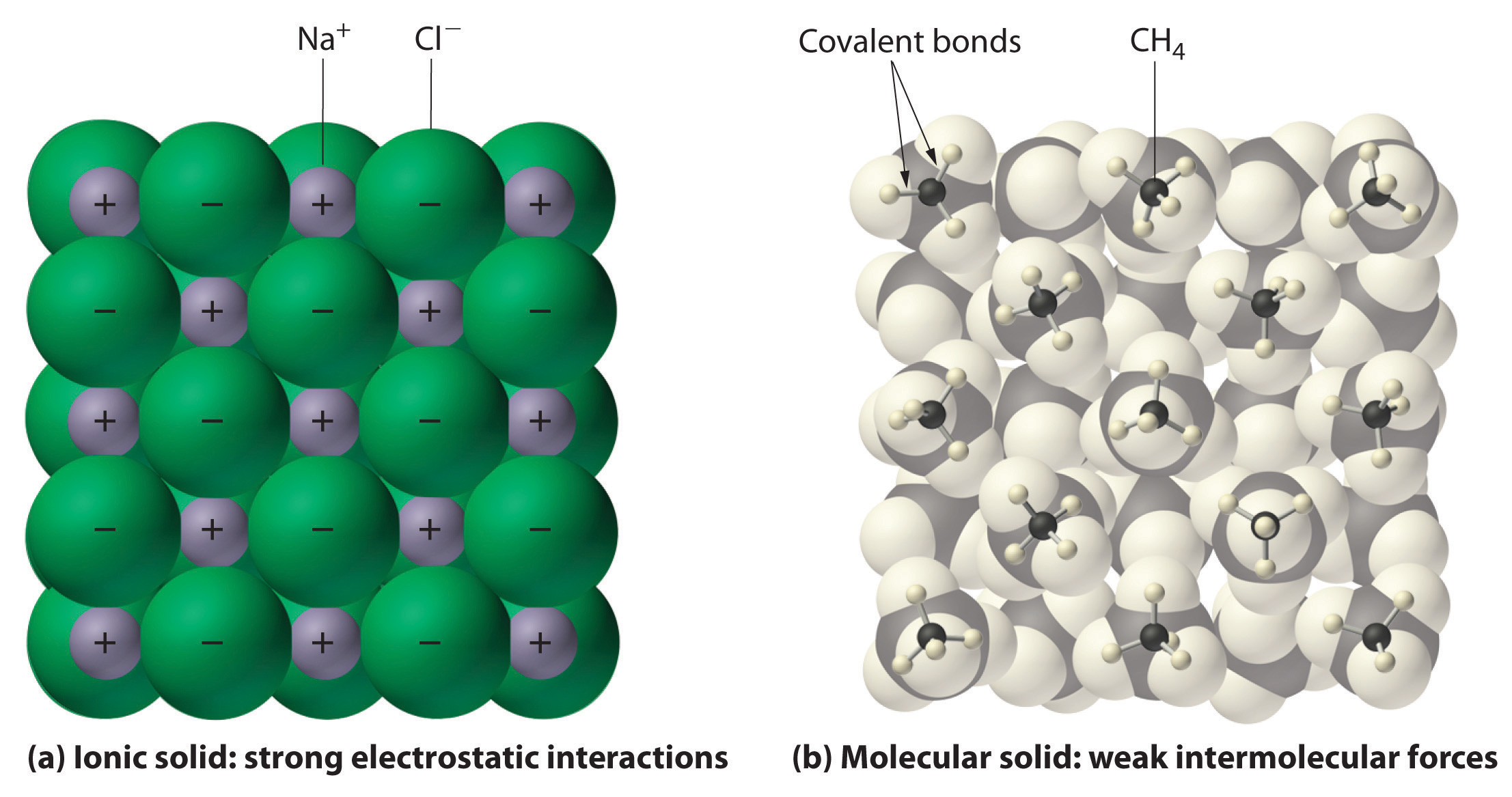 composés covalents, présentent un large éventail de propriétés physiques en raison des différents types d’attractions intermoléculaires tels que différents types d’interactions polaires. Les points de fusion et d’ébullition des composés moléculaires sont généralement assez faibles par rapport à ceux des composés ioniques. En effet, l’énergie nécessaire pour perturber les forces intermoléculaires entre les molécules est bien inférieure à l’énergie nécessaire pour briser les liaisons ioniques dans un composé ionique cristallin (Figure \(\PageIndex{1}\)) ., Les solides ioniques fondent généralement à des températures élevées et bouillent à des températures encore plus élevées. Par exemple, le chlorure de sodium fond à 801 °C et bout à 1413 °c. (à titre de comparaison, l’eau du composé moléculaire fond à 0 °C et bout à 100 °C.). La solubilité dans l’eau des composés moléculaires est variable et dépend principalement du type de forces intermoléculaires impliqués.
composés covalents, présentent un large éventail de propriétés physiques en raison des différents types d’attractions intermoléculaires tels que différents types d’interactions polaires. Les points de fusion et d’ébullition des composés moléculaires sont généralement assez faibles par rapport à ceux des composés ioniques. En effet, l’énergie nécessaire pour perturber les forces intermoléculaires entre les molécules est bien inférieure à l’énergie nécessaire pour briser les liaisons ioniques dans un composé ionique cristallin (Figure \(\PageIndex{1}\)) ., Les solides ioniques fondent généralement à des températures élevées et bouillent à des températures encore plus élevées. Par exemple, le chlorure de sodium fond à 801 °C et bout à 1413 °c. (à titre de comparaison, l’eau du composé moléculaire fond à 0 °C et bout à 100 °C.). La solubilité dans l’eau des composés moléculaires est variable et dépend principalement du type de forces intermoléculaires impliqués.
Figure \(\PageIndex{1}\) Interactions dans les solides ioniques et covalents.,
(a) les ions chargés positivement et négativement dans un solide ionique tel que le
chlorure de sodium (NaCl) sont maintenus ensemble par de fortes interactions électrostatiques.
(b) dans cette représentation de l’emballage des molécules de méthane (CH4) dans le méthane solide,
un solide moléculaire prototypique, les molécules de méthane ne sont maintenues ensemble
dans le solide que par des forces intermoléculaires relativement faibles, même si
les atomes de chaque molécule de méthane sont maintenus ensemble par de fortes liaisons covalentes.,
étant donné que les composés moléculaires sont composés de molécules neutres, leur conductivité électrique est généralement assez faible, que ce soit à l’état solide ou liquide. Sous forme solide, un composé ionique n’est pas électriquement conducteur car ses ions sont incapables de circuler (« électricité” est le flux de particules chargées). Lorsqu’il est fondu, cependant, il peut conduire de l’électricité car ses ions sont capables de se déplacer librement à travers le liquide (Figure \(\PageIndex{2}\); Vidéo \(\PageIndex{1}\)).,

Figure \(\PageIndex{2}\) le chlorure de Sodium fond à 801 °C et conduit l’électricité lorsqu’il est fondu. (crédit: modification du travail de Mark Blaser et Matt Evans)
conductivité du sel fondu
Vidéo \(\PageIndex{1}\) Regardez cette vidéo pour voir un mélange de sels fondre et conduire l’électricité.
Le tableau ci-dessous résume certaines des différences entre ioniques et moléculaires des composés.,>
solubilité dans l’Eau
Un type de composé moléculaire se comporte tout à fait différemment que celle décrite jusqu’à présent., Un solide de réseau covalent est un composé dans lequel tous les atomes sont reliés les uns aux autres par des liaisons covalentes. Le diamant est composé uniquement d’atomes de carbone, chacun lié à quatre autres atomes de carbone dans une géométrie tétraédrique. La fusion d’un solide de réseau covalent n’est pas réalisée en surmontant les forces intermoléculaires relativement faibles. Au contraire, toutes les liaisons covalentes doivent être rompues, un processus qui nécessite des températures extrêmement élevées. Le diamant, en fait, ne Fond pas du tout. Au lieu de cela, il se vaporise en un gaz à des températures supérieures à \(3500^\text{o} \text{C}\).,
résumé
- Les propriétés physiques d’un matériau sont affectées par les forces intermoléculaires qui maintiennent les molécules ensemble.
- Les composés ioniques forment généralement des solides cristallins durs avec des points de fusion élevés. Les composés moléculaires covalents, en revanche, sont constitués de molécules discrètes maintenues ensemble par de faibles forces intermoléculaires et peuvent être des gaz, des liquides ou des solides à température et pression ambiantes.
- Les composés ioniques sous forme fondue ou en solution peuvent conduire l’électricité alors que les composés moléculaires ne le font pas..,
contributeurs
-
Marisa Alviar-Agnew (Sacramento City College)
-
Paul Flowers (Université de Caroline du Nord – Pembroke), Klaus Theopold (Université du Delaware) et Richard Langley (Stephen F. Austin State University) avec des auteurs contributeurs. Le contenu du manuel produit par OpenStax College est sous licence Creative Commons Attribution License 4.0. Télécharger gratuitement à http://cnx.org/contents/85abf193-2bd…[email protected]).,la Fondation CK – 12 de Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson et Jean Dupon.