catalyse hétérogène
en catalyse hétérogène, le catalyseur est dans une phase différente des réactifs. Au moins l’un des réactifs interagit avec la surface solide dans un processus physique appelé adsorption de telle sorte qu’une liaison chimique dans le réactif devient faible et se brise ensuite. Les Poisons sont des substances qui se lient de manière irréversible aux catalyseurs, empêchant les réactifs de s’adsorber et réduisant ou détruisant ainsi l’efficacité du catalyseur.,
un exemple de catalyse hétérogène est l’interaction de l’hydrogène gazeux avec la surface d’un métal, tel que Ni, Pd ou Pt. Comme le montre la partie (a) de la Figure \(\PageIndex{2}\), les liaisons hydrogène–hydrogène se brisent et produisent des atomes d’hydrogène adsorbés individuels à la surface du métal. Parce que les atomes adsorbés peuvent se déplacer sur la surface, deux atomes d’hydrogène peuvent entrer en collision et former une molécule d’hydrogène gazeux qui peut ensuite quitter la surface dans le processus inverse, appelé désorption. Les atomes h adsorbés sur une surface métallique sont sensiblement plus réactifs qu’une molécule d’hydrogène., Étant donné que la Liaison H–H relativement forte (énergie de dissociation = 432 kJ/mol) a déjà été rompue, la barrière énergétique pour la plupart des réactions de H2 est sensiblement plus faible à la surface du catalyseur.
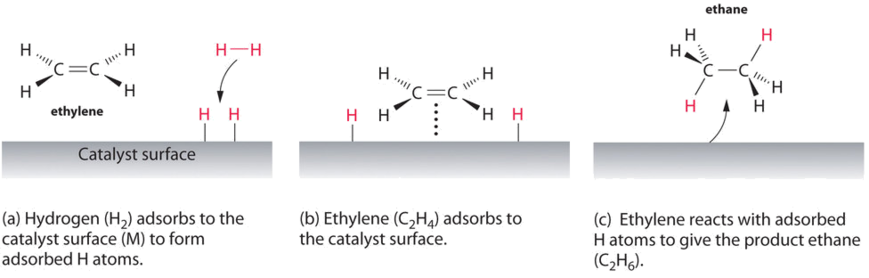
La Figure \(\PageIndex{2}\) montre un processus appelé hydrogénation, dans lequel des atomes d’hydrogène sont ajoutés à la double liaison d’un alcène, tel que l’éthylène, pour donner un produit contenant des liaisons simples C–C, en l’occurrence l’éthane., L’hydrogénation est utilisée dans l’industrie alimentaire pour convertir les huiles végétales, qui consistent en de longues chaînes d’alcènes, en dérivés solides plus précieux sur le plan commercial qui contiennent des chaînes alkyles. L’hydrogénation de certaines des doubles liaisons dans les huiles végétales polyinsaturées, par exemple, produit de la margarine, un produit ayant un point de fusion, une texture et d’autres propriétés physiques similaires à celles du beurre.
Plusieurs exemples importants de réactions catalytiques hétérogènes industrielles se trouvent dans le tableau \(\PageIndex{1}\)., Bien que les mécanismes de ces réactions soient considérablement plus complexes que la simple réaction d’hydrogénation décrite ici, ils impliquent tous l’adsorption des réactifs sur une surface catalytique solide, la réaction chimique des espèces adsorbées (parfois via un certain nombre d’espèces intermédiaires), et enfin la désorption des produits de la surface.