Johdanto
talven Aikana, joskus ihotautilääkärit saada oireettomilla potilailla, joilla ei ole erityisiä vaurioita muuta kuin ehkä joitakin post-inflammatoriset värimuutoksia, mutta kipeästi apua. He alkavat kertoa tarinaa useista näppylöistä tai rakkuloista, jotka ilmaantuvat iholleen vuoden ensimmäisen voimakkaan auringolle altistumisen jälkeen., Yhdessä vaurioita, kauhea kutina alkaa ja kasvaa taudin leviäminen, seuraavan auringolle altistuminen, joskus pahentaa eräänlainen polttava tunne. Kuitenkin, tämä kansa on malli aurinko hakijoita ja edelleen nauttia auringosta koko kesän, odottaa, että näppylät vähitellen haalistuvat ja katoavat. Tärkeimmät kysymykset ovat: miten voin estää tämän? Miksi olen saanut tämän ongelman ”5” vuoden jälkeen, mutta minulla ei ole ollut sitä ennen?,
Olemme todennäköisesti tekemisissä polymorfinen valon purkaus (PLE) ja, seuraava pyyntöjä potilaille, lääketieteellinen tutkimus on pääasiassa keskittynyt ehkäisyn strategiat ovat nykyään varsin tyydyttävä. Toisella puolella, toinen ja varmasti vähemmän tutkittu kysymys jää epäselväksi, jos useita paloja on lisätty pikemminkin vaikeuttaa palapeli. Tämän lyhyen tarkastelun tavoitteena on jatkaa viimeisimpiä edistysaskeleita mahdollisissa PLE-mekanismeissa ja käytetyimmissä ehkäisy-tai hoitoprotokollissa.
polymorfisen Valonpurkauksen Patofisiologia: What ’ s New?,
PLE on yleisin valoherkkä häiriö, jolle on ominaista ajoittainen purkaus ei-arpia kutiseva punoittava näppylät, rakkulat tai laattoja (Kuva 1), jotka kehittyvät muutaman tunnin kuluessa ultraviolettisäteilylle (UVR) altistuminen potilaan iho. Tauti on riippuvainen geneettinen alttius, sekä ympäristön komponentti, kuten tyyppi altistus. PLE näyttää klusterin perheissä: on arvioitu, että esiintyvyys PLE oli 21 ja 18% vuonna monozygotic ja dizygotic kaksoset, vastaavasti (1)., Lisäksi, positiivinen suvussa PLE ensimmäisen asteen sukulaisia oli läsnä 12% vaikuttaa twin paria osalta 4% ennallaan twin paria (p < 0.0001). Se probandwise konkordanssi vuonna monozygotic oli parempi kuin dizygotic twin paria (0.72 vs. 0,30 euroa, vastaavasti), jotka osoittavat vahva geneettinen vaikutus (1). Monia PLE: n patogeneesiin mahdollisesti liittyviä geenejä on tutkittu yleisesti raadollisin tuloksin., Segregaatioanalyysin avulla on arvioitu, että 72 prosentilla Yhdistyneen kuningaskunnan väestöstä on alhainen penetrance PLE herkkyys alleeli (2).
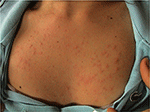
Kuva 1. Kliininen kuva polymorfisesta valonpurkauksesta nuorella naisella.
Epäonnistumisesta Apoptoosin: Mahdollinen Kuva-Aiheuttama Neo Antigeenejä
viime genome-wide ilmaisun analyysi, vasta 16-geenit olivat eri tavoin ilmaistuna välillä PLE ja terve valvontaa sen jälkeen, kun UV-säteilytys osalta ohjaus (3)., Näistä geeneistä, 14 osoitti pienempi ilmaisun PLE-potilailla, kun taas kaksi johti yli-ilmaistu. Joukossa 14 geenien kanssa pienempi ilmaisun PLE ovat: täydentävät 1s-alayksikkö (C1s), scavenger-reseptorin B1 (SCARB1) fibronektiini (FN1), immunoglobuliinien superperheen jäsen 3 (IGSF3), caspase-1 (CASP1) ja paraoxonase 2 (PON2), kaikki geenit liittyvät apoptoottisten solujen puhdistuma. On oletettu, että apoptoottisen solun puhdistuman aikana tapahtunut proteiinin muutos voi johtaa mahdolliseen auto-antigeenin muodostumiseen (4)., Sitten, vähentää ilmaisun PLE potilailla geenien yhteydessä tämä prosessi voi edustaa mahdollista auto-antigeenin lähde, samoin kuin ratkaisevan vaiheen aloittamisen autoimmuunisairaus prosessi, joka edistää taudin (3). Näiden havaintojen mukaisesti Kuhn ym. osoitti kertyminen apoptoottisten solujen PLE potilaat säteilytetty joko 1,5 Minimaalinen Punoitus Annos (MED), UVB, tai 60-100 J/cm2 UVA1, kontrolleihin verrattuna (5).,
Immuniteetti: Suvaitsevaisuus on Vika
Auto-antigeenejä, jotka johtuvat tehoton puhdistuma apoptoottiset solut, ovat luultavasti tarttunut dendritic solujen (DCs) ja se on esitetty naiiveja T-soluja (sytotoksinen ja auttaja) sen jälkeen muuntaa automaattisesti reagoivia T-soluja (6, 7). Tämä osittainen epäonnistuminen apoptoosin osaltaan, yhdessä riittämätön immunosuppressio jälkeen UV-altistuksen, jotta antigeenin tunnustamista ja esittely, johtava kliininen ilmentymä tyypillinen PLE-potilailla (8)., Todellakin, vika normaali uv-säteily-aiheuttama immunosuppressio on osoittautunut niin tärkein immunologinen poikkeavuus PLE, selitti aluksi, jonka pysyvyys Langerhans solut (LCs) iho. Tämä yli-aktivointi immuunijärjestelmän, joka pakenee toimiva UV-säteilyn aiheuttama toleranssi, on luultavasti vastuussa vähentää ihosyövän esiintyvyys PLE-potilailla (9). Toisaalta sama mekanismi on syyllinen allergisen kosketusihottuman (ACD) eston epäonnistumiseen UVR-altistuksen jälkeen (10).,
Tulehduksellinen Polku: Viivästyneen Yliherkkyysreaktion
immunologisten mekanismien mukana PLE, jossa sovittelijat päässä synnynnäisen ja adaptiivisen immuunijärjestelmän, ovat hyvin samanlaisia, joko histologisesti tai biokemiallinen näkökulmasta, ACD niistä. Itse asiassa, alussa seitsemänkymmentäluvun, Epstein ensin ilmoitti, PLE kuin viivästyneen yliherkkyysreaktion (DTHR) määrittelemättömiä uv-säteily-aiheuttama ihon antigeeni (11). Äskettäin, vahvistaa tätä käsitettä, joidenkin tulehdusvälittäjäaineiden mukana ACD on osoitettu myös PLE., Esimerkiksi IL-1-perheeseen (12, 13), kasvava ryhmä sytokiineja, jotka pelata useita rooleja immuuni asetus ja tulehdus (14), mukana myös ACD synnyssä (12, 15), on tutkittu myös PLE (16). IL-36α ja IL-36γ, pro-inflammatorisia jäsenet IL-1 perhe oli kasvanut PLE osalta valvontaa, kuten ACD näytteitä, mutta IL-36γ oli paljon parannettu PLE kuin ACD (16). Kautta toimivat yhteisen reseptori koostuu IL-36R ja IL-1R/Akt (IL-1RL2), IL-36α, IL-36β, ja IL-36γ aktivoi NF-kB ja MAPKs, edistää tulehduksellinen reaktioita., Kasvu IL-36s ihon ja perifeerisen veren PLE-potilaiden osoittaa aktivointi paikallinen ja systeeminen immuunivasteen, löytyy useita tulehdukselliset ihosairaudet (15, 17, 18). Luultavasti, yhteys IL-36s ja uv-säteilylle altistuminen edustaa paracrine pro-inflammatorisia signaali toll kaltainen reseptori (TLR)-3 aktivointi, koska vapauttaa RNA, jonka nekroottisia keratinosyyttejä (19). Todellakin, vika apoptoottisen puhdistuma PLE, jossa on runsaasti solujen roskia, voisi olla vastuussa vahvistus tämä ”hälytys signaali.,”
Lisäksi IL-36s voisi osaltaan vahvistaa synnynnäisen immuniteetin signaalin ja seurauksena tulehduksellinen cascade, joka edistää antimikrobisia peptidejä (Ampeeria) (20).
Tulehduksellinen Polku: Ampeeria ja Microbiome
Kuten laajalti tutkinut useita ihon tulehduksia, näitä välittäjiä, nimetty defensins (α ja β), cathelicidin (LL37), ribonuclease 7 (RNase7) ja psoriasin (S100A7) valossa epätasapaino aiheuttama uv-säteilylle on keratinosyyttien ja skin microbiome, on myös tutkittu PLE (21, 22). Patra ym., ovat havainneet, että psoriasiinin, RNase7: n, HBD-2: n ja LL-37: n ilmentyminen lisääntyi ihon psoriasiksessa, kun taas HBD-3: n ilmentyminen väheni. Ottaen huomioon ihon pinnalle, kuten ”monikulttuuriset maailman”, unohtamatta keskeinen rooli keratinosyyttien, emme voi sulkea pois mahdollisuutta, että Ampeeria julkaisu voisi määräytyy muutos microbiome osia kun UV-vuorovaikutus (23). Mikrobiomi voi itse asiassa edustaa PLE-potilailla muodostuneiden mutta havaitsemattomien UVR-indusoitujen antigeenien suoraa tai epäsuoraa lähdettä, mikä johtaa keratinosyyttivaurioon., Tämän seurauksena myös UVB: n indusoima LL-37, IFNy, TNF-α, IL-6, voisi edustaa PLE: n potentiaalista epäsuoraa kuljettajaa (23). Se voi muodostaa aggregaatteja self-nukleiinihapot voi aktivoida pDCs: psoriasis se on tunnustettu tärkein autoantigen (24). Vaikka PLE potilaiden täydellinen puuttuminen pDCs on raportoitu (25), autoimmune milieu on olemassa, ja LL-37 voisi olla keskeinen rooli, asiakkuutta muut tulehduksellinen väyliä. Kuvassa S1 (Lisämateriaali) edellä esitetyt käsitteet visualisoidaan sarjakuvassa.
polymorfisen Valonpurkauksen hoito: What ’ s New?,
ensimmäinen PLE-hoitolinja sisältää aurinkovoiteet, aurinkovoiteet ja paikallisesti käytettävät kortikosteroidit (26). Kaikille potilaille ennaltaehkäisevä hallinta on olennainen aikana aurinkoinen sää, jonka välttäminen voimakas uv-säteilylle altistuminen ja käyttää suojavaatteita, sekä soveltaminen aurinkovoidetta, erityisesti aikana ensikosketus vuoden. Uuden sukupolven laajakirjoinen aurinkovoiteet, joissa on korkea suojakerroin UVB (SPF) yhdessä pidemmän aallonpituuden UVA-suoja, on ilmoitettu myöntää täydellisen tai osittaisen suojan jopa 90% PLE potilaat (27, 28)., Suun kautta otettavien antioksidanttien ja nikotiiniamidin käyttö voi olla näille potilaille Pätevä ehkäisevä lisätoimenpide. Myönteisiä vaikutuksia nikotiiniamidi on tutkittu hallitsematon tutkimuksessa 42 potilaalla, jossa 60% heistä ilmoitti, täydellistä poistamista oireita, kun käytät 2-3 g nikotiiniamidi päivittäin, ennen auringolle altistumista (29). Lisäksi trooppisen saniaispolyfodiumleucotomos [PL) – uutteella on osoitettu olevan sekä voimakkaita antioksidantti-että immunomodulatorisia vaikutuksia., Kun valmistetta annettiin 480 mg/vrk ennen altistusta auringolle, se vähensi ihoreaktioita ja subjektiivisia oireita merkitsevästi (30, 31). Paikallisesti käytettävien kortikosteroidien osalta, vaikka niiden tehoa PLE: ssä ei ole tutkittu, niitä käytetään laajalti kutinan vähentämiseen (26). Toinen hoitolinja PLE: lle sisältää systeemiset kortikosteroidit ja photo(chemo) – hoidon (26). Satunnaistetussa, kaksoissokkoutetussa, lumekontrolloidussa tutkimuksessa (32) kirjoittajat ehdottivat 25 mg prednisolonia päivittäin 4-5 päivän ajan purkauksen alkaessa., Vaikka mahdollisia pitkäaikaisia haittavaikutuksia toistuva kursseja prednisoloni on otettava huomioon, se voisi olla suositeltavaa potilaille, jotka kärsivät satunnaisia hyökkäyksiä PLE, ilman mitään vasta-aiheet. Lievemmissä PLE-tapauksissa saattaa olla riittävää, että jatko-opinnot altistuvat auringonvalolle keväällä (33). Ottaa huomioon, vaikeammissa tapauksissa lääketieteellisesti valvottu ilmastointi/siedätyshoito voi olla sopivampi., Kurssin psoraleeni ja UVA-yhdistelmähoitoa (PUVA), kapeakaistaista (NB)-UVB-tai laajakaista (BB)-UVB-valohoitoa, yleensä annetaan aikaisin keväällä, voi olla tehokas sekä ennalta ehkäisevään hoitoon (26). Hoitoprotokolla koostuu yleensä yhdestä valohoito – / valokemiahoidosta 5-6 viikon aikana. Aloitusannos riippuu minimal erythemal dose (MED) tai vähintään fototoksinen annos (MPD), ja ovat usein 50-70 prosenttia näistä on mitattu raja-arvoja, vähitellen lisää., Siedätyshoidolla hankitun hyödyn säilyttämiseksi suositellaan säännöllistä auringolle altistumista koko kesän ajan, muuten kovettuminen voi hävitä 4-6 viikon kuluessa. Hoidossa PLE -, NB-UVB olisi edullista PUVA (vahvuus suositus D; näytön taso 4), koska pienempi riski photocarcinogenesis, ei riskiä pahoinvointia tai muita haittavaikutuksia, jotka liittyvät suun MOPPI, ja ei tarvitse käyttää post-hoito silmien suojaus. PUVA on kuitenkin otettava huomioon ennen muita systeemisiä hoitoja, jos NB-UVB on epäonnistunut tai on aiemmin laukaissut purkauksen., Itse asiassa, kuten on kuvattu alla, sen teho on todistettu useiden valohoitoa hoito (BB-UVB -, NB-UVB-ja PUVA), ja sivuvaikutuksia, aikavälillä ihottuma provokaatio, punoitus ja kutina havaittiin olevan enemmän yhteistä UVB kuin PUVA-hoitoa (34). Kuten kirjallisuudessa on tiivistetty, PUVA-valmisteen teho johtaa 65-100%: n fotoprotektionopeuteen (34)., Useita vertailevia tutkimuksia ei ole tehty, mutta ainoa satunnaistettu kontrolloitu tutkimus välillä PUVA-ja NB-UVB plus lumetabletit, kolme kertaa viikossa, 5 viikkoa, ei merkittävää eroa tehossa syntyi, kun otetaan huomioon esiintyminen PLE tai ulkoiluun rajoitus (35). In the 10 years retrospective review, reported by Man et al. (36) 170 keskivaikeaa tai vaikeaa PLE: tä sairastavaa potilasta sai PUVA-ja/tai UVB-valohoitoa. Yksityiskohtaisesti, 8 potilaat saaneet PUVA-hoitoa, 128 NB-UVB, 5 BB-UVB, ja 29 potilasta, jotka eivät vastaa tyydyttävästi NB-UVB, annettiin PUVA seuraavana vuonna., Vakavuudesta tehtiin itsearviointeja, ja PLE-jaksojen esiintymistiheydestä raportoitiin seurantakäynneillä syksyllä tai seuraavan kevään aikana. Hyvää tai kohtalaista paranemista raportoitiin 88%: lla PUVA-hoitoa saaneista ja 89%: lla UVB-hoitoa saaneista potilaista. Sekä PUVA-että NB-UVB-valmisteella hoidetuista potilaista suurin osa piti PUVAA parempana. Toisessa 14-vuotta retrospektiivinen tutkimus 79 saaneilla potilailla valohoitoa (37), teho-mitattuna aikana seuraavana kesänä aikavälillä fotoprotección kanssa täydellinen/osittainen remissio, oli 65%, PUVA, 82% BB-UVB ja 83% UVA yksin., Tällöin PUVA-hoito oli varattu vakavammille PLE-muodoille.
mekanismeja, joilla valohoito indusoi fotoprotektiota, ei täysin tunneta.
viime vuosina on kuitenkin tapahtunut paljon edistystä. Lisäksi tunnettuja vaikutuksia melaninization ja orvaskeden paksuuntumista valohoitoa, laaja valikoima UV aiheuttama immunomodulatorisia ja anti-inflammatorisia ominaisuuksia, on raportoitu (38)., Sekä UVB-ja UVA-moduloida tarttuvuus molekyyli, ilme ja aiheuttaa liukoisten välittäjäaineiden, kuten a-melanosyyttiä stimuloiva hormoni, IL-10 (, joka estää tuotannon interferoni-γ) ja prostaglandiini E2, että selittäviä anti-inflammatoriset toimia, estää T-solujen aktivointi ja edistää apoptoosin tunkeutuu ihon T-solujen (34). Lisäksi on osoitettu, että ennalta ehkäisevää UV photohardening vuonna PLE potilaat palauttaa UV-säteilyn aiheuttama LC siirtyminen orvaskeden iho-tyhjennys imusolmukkeiden: yksi avain cellular tapahtuma UV-immunosuppression (39)., Toleranssin aiheuttama LC välittyy vapautuminen immunosuppressiivisten sytokiinien, kuten IL-10, ja häiriöitä kypsymisen ja induktio regulatory T-solut (Tregs) (40). Lisäksi viime aikoina on raportoitu mielenkiintoinen yhteys LC, Tregs ja D3-vitamiini. Todellakin, se on osoitettu, että lyhyellä aikavälillä 1 viikko ajankohtaisia pre-hoidon 1,25-hydroksi-D-analoginen, calcipotriol, vähentynyt PLE oireita sen jälkeen, kun myöhempi kokeellinen photoprovocation (41)., Lisäksi hiiren tutkimuksessa 1,25-dihydroksivitamiini D osoitti vastaavia immunosuppressiivisia vaikutuksia kuin UV (42). Toinen mielenkiintoinen suojatie on korostunut LCs: n ja syöttösolujen välillä. Lisäksi heidän tunnustettu rooli atopia, ihon syöttösolut ovat myös vastuussa suojella ihoa UVB aiheuttama tulehdus, edistää UV-immunosuppression (40). Ihmisen tutkimukset ovat osoittaneet, että akuutin ja kroonisen UVR-altistuksen jälkeen ihon syöttösolujen määrä kasvaa yhdessä IL-10: n vapautumisen kanssa., Kaiken kaikkiaan nämä tiedot viittaavat syöttösolujen mahdolliseen rooliin PLE: ssä ja fotohardenoinnin mekanismissa. Tämän mukaisesti, Wolf et al. ovat ilmoittaneet ensimmäistä kertaa, että fotohardenointi lisää merkittävästi syöttösolujen tiheyttä PLE-potilaiden papillaarisessa verinahassa (40). Yhteenveto, photohardening toimii PLE palauttamalla normaali UV-immuuni tukahduttava koulutusjakso, johon sisältyy useita solutyyppejä. Kolmannen linjan PLE-hoitoon kuuluu systeemisten immunosuppressiivisten lääkkeiden, kuten atsatiopriinin ja siklosporiinin, käyttö., Kirjallisuudessa on kuitenkin raportoitu vain satunnaisesti hoidettuja potilaita (43, 44). Lisäksi, hydroksiklorokiini, omega-3-rasvahappoja ja beta-karoteeni on ehdotettu hoitoja, mutta edelleen double-blind, satunnaistetussa kontrolloiduissa tutkimuksissa todella arvioida niiden kliinistä tehoa tarvitaan.
Johtopäätökset
Koska korkea esiintyvyys ja lisääntyvä PLE, liittyy epämukavuutta ja elämäntapa rajoituksia, tulevaisuuden tutkimukset ovat tarpeen löytää romaani hoito-ja/tai ennalta ehkäiseviä strategioita., Valinta sopiva PLE hoito edellyttää hyvää tietämystä yksittäisten kliininen taudinkulku yhdessä mahdollisuus suorittaa phototest. Tulehdusprosessin mahdollisessa aktivoinnissa ja edistämisessä on tuotu esiin joitakin uusia puolia.,
nykyinen tietämys, huolimatta tunnistaa joitakin tärkeitä solujen asetuksen mukana palauttaminen immuuni toleranssi, se on vaikea tehdä lopullisia johtopäätöksiä tehosta eri mahdollisia hoitoja PLE, koska ei ole riittävästi tutkimuksia ja vaikeus arvioida tuloksen toimenpiteitä. PLE-vaikeusasteen (PLESI) (45) arviointiin tarvittava kliininen pistemäärä on edelleen väline, jota ei juurikaan käytetä ja joka rajoittuu lähinnä tutkimustarkoituksiin., Häiriön taustalla olevien patogeneettisten mekanismien syvempi tutkiminen mahdollistaa kohdennetumman hoitomuodon.
kirjoittajan osuudet
SL projisoi käsikirjoituksen, valitsi materiaalin paperille, kirjoitti alkuperäisen luonnoksen ja korjasi seuraavat luonnokset käsikirjoituksesta. AR oli mukana kirjoittamassa käsikirjoitusta, tukemassa uusia ajatuksia sisällöstä ja tyylistä.,
eturistiriita Lausunto
kirjoittajat ilmoittavat, että tutkimus on tehty ilman mitään kaupallisia tai taloudellisia suhteita, jotka voitaisiin tulkita mahdollisia eturistiriitoja.
oheismateriaali
Kuva S1. Vuorovaikutus synnynnäinen ja adaptiivinen immuunijärjestelmä yhteydessä apoptoosi epäonnistuminen orvaskeden. (Vihreä symboli) Psoriasiini: runsas ilmaisu spinous ja rakeinen kerrokset PLE ihon. (Sininen symboli) RNase7: pääasiassa ilmaistu keratinosyyttien stratum granulosum ja sarveiskerroksen PLE vaurioita., LL-37 ilmaistiin perusteellisesti verisuonissa ja rauhasten ympärillä PLE: ssä. Apoptoottiset keratinosyytit, joiden puhdistuma on tehoton.,hic light eruption; ACD, Allergic contact dermatitis; DTHR, Delayed type hypersensitivity reaction; UVR, Ultraviolet radiation; C1s, Complement 1s subunit; SCARB1, Scavenger receptor B1; FN1, Fibronectin; IGSF3, Immunoglobulin superfamily member 3; CASP1, Caspase-1; PON2, Paraoxonase 2; MED, Minimal Erythema Dose; DCs, Dendritic cells; LCs, Langerhans cells; TLR, Toll like receptor; AMPs, Antimicrobial peptides; SPF, Sun protection factor; PUVA, Psoralen and UVA therapy; NB-UVB, Narrowband; BB-UVB, Broadband UVB; MPD, Minimum phototoxic dose; Tregs, Regulatory T cells; PL, Polypodiumleucotomos.,
2. McGregor JM, Grabczynska S, Vaughan R, Hawk JL, Lewis CM. Genetic modelling of abnormal photosensitivity in families with polymorphic light eruption and actinic prurigo. J Invest Dermatol. (2000) 115:471–6. doi: 10.1046/j.1523-1747.2000.00080.x
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Lembo S, Hawk JLM, Murphy GM, Kaneko K, Young AR, McGregor JM, et al., Aberrant gene expression with deficient apoptotic keratinocyte clearance may predispose to polymorphic light eruption. Br J Dermatol. (2017) 177:1450–3. doi: 10.1111/bjd.15200
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Savill J, Fadok V. Corpse clearance defines the meaning of cell death. Nature (2000) 407:784–8. doi: 10.,1038/35037722
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Kuhn A, Herrmann M, Kleber S, Beckmann-Welle M, Fehsel K, Martin-Villalba A, et al. Accumulation of apoptotic cells in the epidermis of patients with cutaneous lupus erythematosus after ultraviolet irradiation. Arthritis Rheum. (2006) 54:939–50. doi: 10.1002/art.21658
PubMed Abstract | CrossRef Full Text | Google Scholar
6., Savill J, Dransfield I, Gregory C, Haslett C. A blast from the past: clearance of apoptotic cells regulates immune responses. Nat RevImmunol. (2002) 2:965–75. doi: 10.1038/nri957
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Albert ML, Sauter B, Bhardwaj N. Dendritic cells acquire antigen from apoptotic cells and induce class I-restricted CTLs. Nature (1998) 392:86–9. doi: 10.,1038/32183
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Koulu LM, Laihia JK, Peltoniemi HH, Jansén CT. UV-induced tolerance to a contact allergen is impaired in polymorphic light eruption. J Invest Dermatol. (2010) 130:2578–82. doi: 10.1038/jid.2010.181
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Epstein JH. Polymorphous light eruption. J Am Acad Dermatol. (1980) 3:329–43.,
PubMed Abstract | Google Scholar
12. Mattii M, Ayala F, Balato N, Filotico R, Lembo S, Schiattarella M, et al. The balance between pro- and anti-inflammatory cytokines is crucial in human allergic contact dermatitis pathogenesis: the role of IL-1 family members. Exp Dermatol. (2013) 22:813–9. doi: 10.1111/exd.12272
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Dinarello CA., Interleukiini-1 tulehdussairauksien patogeneesissä ja hoidossa. Blood (2011) 117:3720-32. doi: 10.1182/verta-2010-07-273417
PubMed Abstrakti | CrossRef Koko Teksti | Google Scholar
16. Lembo S, Caiazzo G, Balato N, Monfrecola G, Patra V, Susi P, et al. Polymorfinen valonpurkaus ja IL-1 perheenjäsenet: onko eroa allergisen kosketusihottuman kanssa? Photochem Photobiol Sci. (2017) 16:1471–9. doi: 10.,1039/c7pp00142h
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Balato A, Schiattarella M, Lembo S, Mattii M, Prevete N, Balato N, et al. Interleukin-1 family members are enhanced in psoriasis and suppressed by vitamin D and retinoic acid. Arch Dermatol Res. (2013) 305:255–62. doi: 10.1007/s00403-013-1327-8
PubMed Abstract | CrossRef Full Text | Google Scholar
19., Borkowski AW, Kuo IH, Bernard JJ, Yoshida T, Williams MR, Hung NJ. Toll-like receptor 3 aktivointi on tarpeen normaalin ihoesteen korjaus jälkeen UV-vaurioita. J. Invest Dermatol. (2015) 135:569–78. doi: 10.1038 / jid.2014.354
PubMed Abstrakti | CrossRef Koko Teksti | Google Scholar
20. Li N, Yamasaki K, Saito R, Fukushi-Takahashi S, Shimada-Omori R, Asano M, et al. Alarmin toiminto cathelicidin antimikrobinen peptidi LL37 läpi IL-36γ induktio ihmisen orvaskeden keratinosyyttejä. J Immunol., (2014) 193:5140–8. doi: 10.4049/jimmunol.1302574
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Patra V, Wolf P. Microbial elements as the initial triggers in the pathogenesis of polymorphic light eruption? Exp Dermatol. (2016) 25:999–1001. doi: 10.1111/exd.13162
PubMed Abstract | CrossRef Full Text | Google Scholar
22., Gläser R, Navid F, Schuller W,Jantschitsch C, Harder JM, Schröder JM, et al. UV-B-säteily indusoi antimikrobisten peptidien ilmentymistä ihmisen keratinosyyteissä in vitro ja In vivo. J Allergia Clin Immunol. (2009) 123:1117–23. doi: 10.1016 / j. jaci.2009.01.043
PubMed Abstrakti | CrossRef Koko Teksti | Google Scholar
23. Patra V, Mayer G, Gruber-Wackernagel A, Horn M, Lembo S, Wolf P., Ainutlaatuinen profiili antimikrobisen peptidin ilmentymisestä polymorfisissa valonpurkauksissa verrattuna terveeseen ihoon, atooppiseen ihottumaan ja psoriasikseen. Photodermatol Photoimmunol Fotomed. (2018) 34:137–44. doi: 10.1111 / phpp.12355
PubMed Abstrakti | CrossRef Koko Teksti | Google Scholar
25. Schweintzger NA, Gruber-Wackernagel A, Shirsath N, Quehenberger F, Obermayer-Pietsch B, Susi, P. Alaisena vuodenaikoina D-vitamiini tasot ja säätelevien T-solujen potilailla, joilla on monimuotoinen valon purkaus., Photochem Photobiol Sci. (2016) 15:440–6. doi: 10.1039/c5pp00398a
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Proby C, Baker C, Morton O, Hawk JLM. New broad spectrum sunscreen for polymorphic light eruption. Lancet (1993) 341:1347–8.
PubMed Abstract | Google Scholar
28. Allas S, Lui H, Moyal D, Bissonnette R., Vertailu kyky 2 aurinkovoiteet suojaavat polymorfista valo purkauksen aiheuttama UV-A/UV-B metal halogenidi lamppu. Arch Dermatol. (1999) 135:1421–2.
PubMed Abstrakti | Google Scholar
29. Ortel B, Wechdorn D, Tanew A, Honigsmann H. Vaikutus nikotiiniamidi on phototest reaktio polymorfista lighteruption. Br J Dermatol. (1988) 118:669–73.
PubMed Abstrakti | Google Scholar
30., Caccialanza M, Percivalle S, Piccinno R, Brambilla R. Photoprotective activity of oral Polypodiumleucotomos extract in 25 patients with idiopathic photodermatoses. Photodermatol Photoimmunol Photomed. (2007) 23:46–7. doi: 10.1111/j.1600-0781.2007.00274.x
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Tanew A, Radakovic S, Gonzalez S, Venturini M, Calzavara-Pinton P. Oral administration of a hydrophilic extract of Polypodiumleucotomos for the prevention of polymorphic light eruption., J Am Acad Dermatol. (2012) 66:58–62. doi: 10.1016/j.jaad.2010.09.773
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Van Praag MCG Boom, BW, Vermeer BJ. Diagnosis and treatment of polymorphous light eruption. Int J Dermatol. (1994) 33:233–9.
Google Scholar
34. Ling TC, Clayton TH, Crawley J, Exton LS, Goulden V, Ibbotson S, et al., British association of ihotautilääkärit ja britannian photodermatology ryhmä suuntaviivat turvallista ja tehokasta käyttöä psoraleeni-ultravioletti hoito 2015. Br J Dermatol. (2016) 174:24–55. doi: 10.1111 / bjd.14317
PubMed Abstrakti | CrossRef Koko Teksti | Google Scholar
36. Mies, Dawe RS, Ferguson J. Keinotekoinen kovettuminen polymorfinen valon purkaus: käytännön kohtia kymmenen vuoden kokemus. Photodermatol Photoimmunol Fotomed. (1999) 15:3–4.,
PubMed Abstract | Google Scholar
37. Mastalier U, Kerl H, Wolf P. Clinical laboratory, phototest and phototherapy findings in polymorphic light eruptions: a retrospective study of 133 patients. Eur J Dermatol. (1998) 8:554–9.
PubMed Abstract | Google Scholar
38. Krutmann J, Morita A. Mechanisms of ultraviolet (UV) B and UVA phototherapy. J Invest Dermatol Symp Proc. (1999) 4:70–2.,
PubMed Abstract | Google Scholar
39. Janssens AS, Pavel S, Out-Luiting JJ, Willemze R, de Gruijl FR. Normalized ultraviolet (UV) induction of Langerhans cell depletion and neutrophil infiltrates after artificial UVB hardening of patients with polymorphic light eruption. Br J Dermatol. (2005) 152:1268–74. doi: 10.1111/j.1365-2133.2005.06690.x
PubMed Abstract | CrossRef Full Text | Google Scholar
40., Susi P, Gruber-Wackernagel A, Bambach minä, Schmidbauer U, Mayer G, Absenger M, et al. Photohardening polymorfisia valon purkaus potilaat vähenee perustason epidermaalinen Langerhans solujen tiheys taas kasvaa mast-solujen määrä vuonna papillaarisen dermis. Exp Dermatol. (2014) 23:428–30. doi: 10.1111 / exd.12427
PubMed Abstrakti | CrossRef Koko Teksti | Google Scholar
42. Schwarz a, Navid F, Sparwasser T, Clausen BE, Schwarz T., 1,25-dihydroxyvitamin D exerts similar immunosuppressive effects as UVR but is dispensable for local UVR-induced immunosuppression. J Invest Dermatol. (2012) 132, 2762–9. doi: 10.1038/jid.2012.238
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Norris PG, Hawk JL. Successful treatment of severe polymorphous light eruption with azathioprine. Arch Dermatol. (1989) 125:1377–9.
PubMed Abstract | Google Scholar