Atomien ja Valon Energiaa
tutkimuksen atomien ja niiden ominaisuudet päällekkäin useita differentsciences. Kemistien, fyysikoiden ja tähtitieteilijöiden kaikkien täytyy ymmärtää themicroscopic asteikko, jossa suuri osa maailmankaikkeudesta toimii nähdäkseen ”isompi kuva”.,
Sisällä Atomi
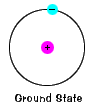 |
perustilan elektroni, energia-tasolla itnormally sijaitsee, on valtion pienin energia, joka electron. |
| Siellä on myös suurin energiaa, että jokainen elektroni kestävä ja silti olla osa sen atom. Tämän energian lisäksi elektronit eivät enää sitoudu atomin ytimeen, ja sen katsotaan olevan ionisoitunut., | 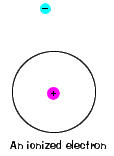 |
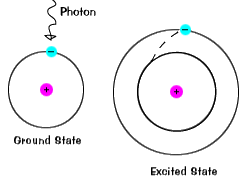 |
Kun elektroni tilapäisesti vie energiaa valtion suurempi kuin itsground valtio, se on innostunut valtion.Elektroni voi tulla innoissaan, jos se on ylimääräistä energiaa, kuten jos itabsorbs fotoni, tai paketti valo, tai törmää lähellä atomi tai hiukkanen. |
Valon Energiaa,
tämän sivun kuvat ovat tietenkin yksinkertaistettuja versioita todellisista atomeista. Todellinen atomit, jopa suhteellisen yksinkertaisia, kuten vetyä,on monia eri orbitaalit, ja niin on paljon mahdollista energieswith eri alkuperäisen ja lopullisen toteaa., Kun atomi on excitedstate, elektroni voi pudota kokonaan maahan valtion kerralla,tai pysähtyä matkalla väli-tasolla.
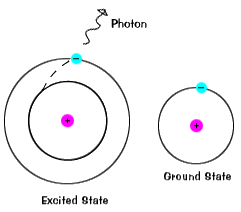 |
Elektronit eivät pysy innoissaan valtioiden kovin pitkään – ne soonreturn heidän maahan todetaan, säteilee fotonin kanssa sameenergy kuin yksi, joka oli imeytynyt., |
Tunnistaa Yksittäisiä eri Atomien
Siirtymät eri orbitaalit ovat ainutlaatuisia kullekin elementille, koska energia-tasot ovat yksikäsitteisesti määrittää protonien ja neutronien thenucleus. Tiedämme, että eri alkuaineilla on eri määrä protoneja ja neutroneja niiden ytimissä. Kun elektronit tietty atomi palaa alempaan orbitalsfrom innoissaan todetaan, että ne säteilevät fotonit ovat energioita, jotka arecharacteristic sellainen atomi., Tämä antaa eachelement ainutlaatuinen sormenjälki, jolloin on mahdollista tunnistaa elementspresent astiaan kaasua, tai jopa tähti.
Voimme käyttää työkaluja, kuten alkuaineiden jaksollisen selvittää, miltä monta protonia, ja näin elektronit atomi on. Ensinnäkin tiedämme, että jotta atomilla olisi neutraali varaus, sillä on oltava sama määrä protoneja ja elektroneja. Jos atomi menettää tai voitot elektroneja, se becomesionized, tai veloitetaan. Jaksollinen järjestelmä antaa meille atomiluku ofan alkuaine. Atomiluku kertoo, kuinka monta protonia atomilla on., Esimerkiksi vedyllä on atomiluku yksi-eli sillä on hasoniprotoni ja siten yksi elektroni-eikä todellisuudessa ole neutroneja.
Opiskelija
Perustuu edellisen kuvaus atom, piirtää amodel vety-atomin. Atomin ”standardimalli” tunnetaan Bohrin mallina.
Eri muodoissa samaa alkuainetta, jotka eroavat vain määrä neutroneja niiden ydin kutsutaan isotooppeja. Useimmat alkuaineet ovat suurempia kuin yksi luonnossa esiintyvä isotooppi., Ydinreaktoreissa ja tieteellisissä laboratorioissa on valmistettu paljon enemmän isotooppeja. Isotoopit eivät yleensä ole kovin stabiileja, ja ne pyrkivät radioaktiiviseen hajoamiseen, kunnes muodostuu jotain vakaampaa. Alkuaine voi olla sinulle tuttu-sillä on useita epästabiileja isotooppeja, U-235 on yksi kaikkein harvinaisimmista tunnetuista. 235 tarkoittaa, että tässä uraanin muodossa on 235 neutronia ja protonia yhdistettynä. Jos tutkimme uraanin atominumeron ja alustamme 235: stä, voisimme laskea isotoopin neutronien määrän.,
Tässä on toinen esimerkki – carbon yleensä esiintyy muodossa C-12 (hiili-12), joka on 6 protonia ja 6 neutronia, vaikka yksi isotooppi C-13, jossa 6protons ja 7 neutronia.
Opiskelija
Käytä jaksollisen ja nimet elementtien alla selvittää, kuinka monta protonit, neutronit ja elektronit he ovat.Piirretään seuraavan alkuaineen atomin malli: pii-28, magnesium-24, rikki-32, happi-16 ja helium-4.,
Opiskelija
Käyttämällä tekstiä, määritä seuraavat ehdot: energian tasoilla, absorptio, emissio, innostunut valtion, maa valtion, ionisaatio,atomi, alkuaine, atomi massa, atomi numero, isotooppi.
On Valinnainen Huomautus Kvanttimekaaninen Luonne AtomienKun Bohr atomin edellä on mukava tapa oppia siitä, atomien rakenne, se ei ole tarkin tapa tomodel niitä., Vaikka jokainen orbital ei ole tarkkaa energiaa, theelectron on nyt ajateltu olevan sotkee pois ”elektroni pilvi”, joka ympäröi ydin. Se on yhteinen puhua keskimääräinen etäisyys thecloud kuin säde, elektroni kiertorata.Joten muistakaa, me pidämme sanaa ”orbit” ja ”orbital”, vaikka me nyt käyttää niitä kuvaamaan ei tasainen kiertoradan kone, mutta aregion, missä elektroni on todennäköisyys että. elektronit pidetään lähellä ydintä ytimen ja elektronien välisen sähköisen vetovoiman avulla.,Pidetään siellä samalla tavalla, että yhdeksän planeettaa pysyvät lähellä aurinkoa sen sijaan, että ne siirtäisivät galaksin. Toisin kuin aurinkokunnassa, jossa kaikkien planeettojen kiertoradat ovat samalla tasolla, elektronien kiertoradat ovat kolmiulotteisempia. Eachenergy tasolla atomin on erilainen muoto. On olemassa mathematicalequations, joka kertoo, todennäköisyys, että elektroni on locationwithin, että kiertoradalla. mietitään vetyatomia, josta jo piirsimme Bohr-mallin.,
tekstiä ja kuvia tässä osiossa oli mukailtu Dave Slaven sivu mat-Atom (ks. Viitteet alla). |

