Nukleofiiliset Korvaaminen Hydroksyyli-Ryhmän puolesta
kemiallinen käyttäytyminen alkyyli halogenidit voidaan käyttää apuna löytämässä analoginen korvaaminen ja poistaminen reaktiot-alkoholit. Päällikkö ero, tietenkin, on muutos lähtee anioni alkaen halidi-hydroksidi. Koska happi on hieman elektronegatiivisempaa kuin kloori (3,5 vs. 2,8 Pauling-asteikolla), c-O-sidoksen odotetaan olevan polaarisempi kuin C-Cl-sidoksen., Lisäksi riippumaton mitta electrophilic ominaisuudet hiiliatomeja alkaen niiden NMR kemialliset siirtymät (sekä 13C ja alfa protonit) osoittaa, että hapen ja kloorin substituentteja käyttää vastaavia electron-vetäminen vaikuttaa kun sidottu sp3 hybridisoitiin hiiliatomia. Lupaavasta taustatiedosta huolimatta alkoholeilla ei ole samoja SN2-reaktioita, joita on yleisesti havaittu alkyylihalideilla. Esimerkiksi 1-bromobutaanin nopea SN2-reaktio natriumsyanidin kanssa alla esitetyllä tavalla ei ole yhdensuuntainen, kun 1-butanolia käsitellään natriumsyanidilla., Etyylialkoholia käytetään usein liuottimena esimerkiksi alkyylihalidin substituutioreaktioissa.
CH3CH2CH2CH2–Br + Na(+) CN(–)  CH3CH2CH2CH2–CN + Na(+) Br(–)
CH3CH2CH2CH2–CN + Na(+) Br(–)
CH3CH2CH2CH2–OH + Na(+) CN(–)  Ei Reaktiota
Ei Reaktiota
keskeinen tekijä tässä on vakaus jättäen anioni (bromide vs. hydroksidi)., HBr on paljon vahvempi happo kuin vettä (yli 18 suuruusluokkaa), ja tämä ero näkyy reaktioita, jotka tuottavat niiden konjugaatti emäkset. Heikompi pohja, bromidi, on vakaampi, ja sen julkaisu vuonna korvaaminen tai poistaminen reaktio on paljon edullisempi kuin hydroksidi-ioni, vahvempi ja vähemmän vakaa pohja.
selkeä askel kohti parantaa reaktiivisuus alkoholit SN2-reaktiot olisi muuttaa –OH toiminnallinen ryhmä tavalla, joka parantaa sen vakautta kuin jättää anioni., Yksi tällainen muutos on suorittaa substituutioreaktio vahvassa hapossa, muuntamalla-OH-oh-OH2 (+). Koska hydroniumioni (H3O (+)) on vettä huomattavasti voimakkaampi happo, sen konjugaattiemäs (H2O) on hydroksidi-Ionia parempi lähtevä ryhmä. Ainoa ongelma tässä strategiassa on, että monet nucleophiles, kuten syanidia, ovat pois käytöstä, protonation vahvat hapot, tehokkaasti poistamaan nukleofiiliset co-lähtöaineen tarvitaan korvaushoitoa., Vahvat hapot HCl, HBr ja HI eivät kuulu tämän vaikeuksia, koska heidän konjugaatti emäkset ovat hyviä nucleophiles ja ovat jopa heikompia emäksiä kuin alkoholit. Seuraavat yhtälöt havainnollistavat alkoholien joitakin substituutioreaktioita, joihin nämä hapot voivat vaikuttaa. Kuten alkyyli halogenidit, että nukleofiiliset korvaaminen 1º-alkoholit tuotot by SN2-mekanismilla, kun taas 3º-alkoholit reagoivat by SN1-mekanismin. 2º-alkoholien reaktioita voi esiintyä molemmilla mekanismeilla ja ne tuottavat usein joitakin uudelleen järjestettyjä tuotteita., Numerot suluissa vieressä mineraalihappoa kaavat edustavat paino prosenttiosuus tiivistettyä vesiliuosta, muodossa, jossa nämä hapot ovat yleensä käytetään.
Vaikka nämä reaktiot ovat joskus kutsutaan ”happo-katalysoivat,” tämä ei ole täysin oikea. Yleinen muutos, vahva HX happo muunnetaan vettä, hyvin heikko happo, joten ainakin stoikiometrinen määrä HX tarvitaan loppuun muuntaminen alkoholin alkyyli halide., Tarve käyttää tässä reaktiossa vastaavia määriä erittäin vahvoja happoja rajoittaa sen käyttökelpoisuuden edellä esitettyihin yksinkertaisiin alkoholeihin. Happoherkät alkoholit eivät tietenkään siedä tällaista hoitoa. Tästä huolimatta ajatusta-OH-funktionaalisen ryhmän muuttamisesta sen vakauden parantamiseksi lähtevänä anionina voidaan jatkaa muihin suuntiin. Seuraavassa kaaviossa esitetään joitakin muutoksia, jotka ovat osoittautuneet tehokkaiksi. Kussakin tapauksessa hydroksyyliryhmä muuttuu vahvan hapon esteriksi. Kaksi ensimmäistä esimerkkiä osoittavat aiemmin kuvatut sulfonaattiesterit., Kolmannen ja neljännen esimerkit osoittavat muodostumista phosphite esteri (X edustaa jäljellä bromines tai muita alkoholia substituentteja) ja chlorosulfite esteri, vastaavasti. Kaikki nämä lähtevät ryhmät (väriltään sininen) on konjugaatti happoja, jotka ovat paljon vahvempia kuin vettä (13-16-powers of ten); näin ollen jättäen anioni on vastaavasti vakaampi kuin hydroksidi-ioni. Se mesylate ja tosylaatti yhdisteet ovat erityisen hyödyllisiä, koska ne voidaan käyttää korvaavia reaktioita monenlaisia nucleophiles., Välituotteiden tuotettu reaktiot alkoholien kanssa, fosforia tribromide ja thionyl chloride (kaksi viimeistä esimerkkiä) ovat harvoin eristetty, ja nämä reaktiot tuottavat edelleen alkyyli-bromidi ja kloridi-tuotteita.
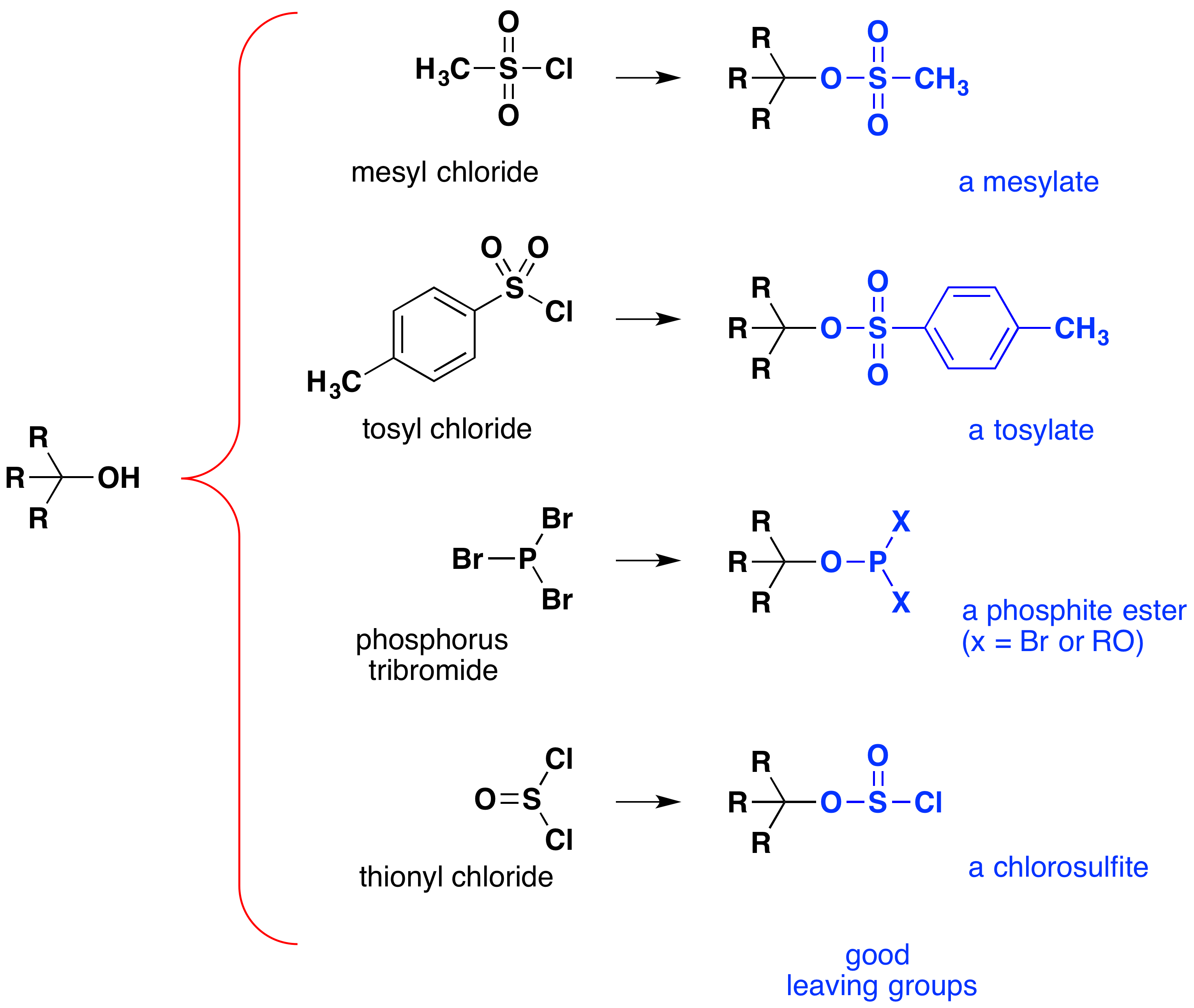
merkitystä ester sulfonaatti välituotteiden yleensä nukleofiiliset korvaaminen reaktiot-alkoholit voidaan havainnollistaa seuraavan muuntaminen 1-butanoli, jotta pentanenitrile (butyyli-syanidi), reaktio ei tapahdu, alkoholin kanssa yksin., Fosfori-ja thionyl halogenidit, toisaalta toimia vain muuntaa alkoholit vastaavaan alkyyli halogenidit.,
| CH3CH2CH2CH2–OH + CH3SO2Cl | pyridine
|
CH3CH2CH2CH2–OSO2CH3 | Na(+) CN(–)
|
CH3CH2CH2CH2–CN + CH3SO2O(–) Na(+) |
Some examples of alcohol substitution reactions using this approach to activating the hydroxyl group are shown in the following diagram., Kaksi ensimmäistä tapausta vahvistavat sitä, että alkoholien sulfonaattiesterijohdannaiset voivat korvata alkyylihalideja erilaisissa SN2-reaktioissa. Kaksi seuraavaa tapausta osoittavat fosfori-tribromidin käytön alkoholien muuttamisessa bromideiksi. Tätä reagenssia voidaan käyttää ilman lisättyä emästä (esim.pyridiiniä), koska fosforihappotuote on HBR: ää heikompi happo. Fosfori-tribromidia käytetään parhaiten 1º-alkoholien kanssa, koska 2º-alkoholeilla saadaan usein kilpailevista SN1-reaktioista johtuvia uudelleenjärjestelytuotteita., Huomaa, että eetterin hapen reaktio 4 ei vaikuta tämän reagenssin, kun taas vaihtoehto synteesin avulla keskittynyt HBr pilkkoo eetterit. Fosforia trichloride (PCl3) muuntaa alkoholit että alkyyli kloridit samalla tavalla, mutta thionyl chloride on yleensä parempana tätä muutosta, koska epäorgaaniset tuotteet ovat kaasut (SO2 & HCl). Fosforitriiodidi ei ole stabiili, vaan sitä voidaan tuottaa situssa punaisen fosforin ja jodin seoksesta ja se muuttaa Alkoholit alkyylijodideiksi., Viimeinen esimerkki osoittaa tionyylikloridin reaktion kiraalisen 2º-alkoholin kanssa. Läsnäolo orgaanisen emäksen, kuten pyridiini on tärkeää, koska se tarjoaa merkittäviä pitoisuus kloridi-ioni tarvitaan lopullinen SN2-reaktio chlorosufite väli., Ilman pohja, chlorosufites hajoavat kuumennettaessa tuottaa odotettavissa alkyyli-kloridin ja säilyttäminen kokoonpano
Tertiääriset alkoholit eivät ole yleisesti käytetty korvaaminen reaktioita tyyppi keskusteltu täällä, koska SN1 ja E1-reaktio polut ovat hallitseva ja on vaikea valvoa.

merkitystä sulfonaatti esterit kuten välituotteita monissa korvaaminen reaktioita ei voida yliarvioida., Tiukkaa todiste siitä, configurational inversio, joka tapahtuu korvaaminen sivuston SN2-reaktiot käyttää tällaisia reaktioita. Esimerkki tällaisesta todisteesta esitetään alla. Yleisemmin käytettyjen sulfonyylijohdannaisten lyhenteet on esitetty seuraavassa taulukossa.
| Sulfonyl Ryhmä | CH3SO2– | CH3C6H4SO2– | BrC6H4SO2– | CF3SO2– |
|---|---|---|---|---|
| Nimi & Abbrev., | Mesyl tai Ms – | Tosyl tai Ts | Brosyl tai Bs | Trifyl tai Tf |
Inversio Todiste

täydellisempi keskustelua hydroksyyli korvaaminen reaktioita ja kuvaus muut selektiiviset menetelmät tämän muutoksen, Klikkaa Tästä.
Avustajat
- William Reusch, Professori Emeritus (Michigan State U.,), Virtual Textbook of Organic Chemistry