lyhyt yhteenveto Haber Prosessi
Haber Prosessi yhdistää typpeä ilmasta vedyllä johdettu pääasiassa maakaasusta (metaani) ammoniakiksi. Reaktio on palautuva ja ammoniakin tuotanto on eksoterminen.,
![]()
![]()
vuokaavio Haber Prosessi näyttää tältä:
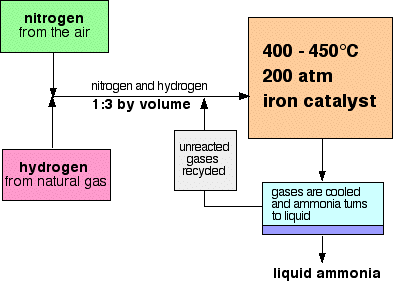
muistiinpanoja edellytykset
katalysaattori
katalysaattori on itse asiassa hieman monimutkaisempi kuin puhdasta rautaa. Siihen on lisätty kaliumhydroksidia promoottorina-ainetta, joka lisää sen tehokkuutta.
paine
paine vaihtelee yhdestä tuotantolaitoksesta toiseen, mutta on aina korkea. 200 ilmakehää lainaavassa kokeessa ei voi mennä pitkälle pieleen.,
Kierrätys
jokaisen pass kaasujen reaktorin läpi, vain noin 15% on typpeä ja vetyä muunnetaan ammoniakkia. (Tämä luku vaihtelee myös kasveittain.) Reagoimattoman typen ja vedyn jatkuvalla kierrätyksellä kokonaismuunnos on noin 98%.
Selittää ehtoja,
osuudet typen ja vedyn
seoksen typpi ja vety menee reaktoriin on suhteessa 1 määrä typpeä 3 määriä vetyä.,
Avogadron lain mukaan samassa lämpötilassa ja paineessa olevien kaasujen yhtä suuret määrät sisältävät yhtä monta molekyyliä. Tämä tarkoittaa sitä, että kaasut menevät reaktoriin suhteessa 1 molekyyli typpeä 3 vetyä.
se on yhtälön vaatima osuus.
joissakin reaktioissa saatat haluta käyttää ylimääräistä yhtä reaktanttia. Tekisit näin, jos toisen reaktorin käyttö olisi erityisen tärkeää – jos se olisi esimerkiksi paljon kalliimpaa. Se ei päde tässä tapauksessa.,
on aina alasivulla käyttää mitään muuta kuin yhtälön mittasuhteet. Jos sinulla on ylimääräinen yhden lähtöaineen siellä on molekyylejä kulkee reaktorin läpi, joka voi reagoida, koska siellä ei ole mitään niitä reagoida. Tämä tuhlaa reaktoritilaa-erityisesti katalyytin pinnalla olevaa tilaa.
lämpötila
Tasapaino näkökohdat
Sinun täytyy siirtää asentoon tasapainon niin pitkälle kuin mahdollista oikealle, jotta voidaan tuottaa suurin mahdollinen määrä ammoniakkia tasapainotilassa seos.,
etureaktio (ammoniakin tuotanto) on eksoterminen.
![]()
![]()
Mukaan Le Chatelier n Periaate, tämä on suosinut, jos alentaa lämpötilaa. Järjestelmä reagoi siirtämällä tasapainotilaa vastapainoksi-toisin sanoen tuottamalla lisää lämpöä.
saadaksesi mahdollisimman paljon ammoniakkia tasapainoseokseen tarvitset mahdollisimman matalan lämpötilan. 400-450°C ei kuitenkaan ole alhainen lämpötila!,
Rate considerations
mitä matalammassa lämpötilassa käytät, sitä hitaammin reaktio muuttuu. Valmistaja yrittää tuottaa mahdollisimman paljon ammoniakkia päivässä. Se ei ole mitään järkeä yrittää saavuttaa tasapainon seos, joka sisältää hyvin suuri osa ammoniakkia, jos se kestää useita vuosia reaktio saavuttaa se tasapaino.
kaasujen on päästävä tasapainoon hyvin lyhyessä ajassa, että ne ovat kosketuksissa reaktorin katalyytin kanssa.,
kompromissi,
400 – 450°C on kompromissi lämpötila tuottaa kohtuullisen suuri osuus ammoniakin tasapaino seos (vaikka se on vain 15%), mutta hyvin lyhyessä ajassa.
paine
Tasapaino näkökohdat
![]()
![]()
Huomaa, että on olemassa 4 molekyylejä vasemmalla puolella yhtälö, mutta vain 2 oikealla.,
Le Chatelierin periaatteen mukaan jos paine kasvaa, järjestelmä reagoi suosimalla reaktiota, joka tuottaa vähemmän molekyylejä. Silloin paine laskee jälleen.
saadaksesi mahdollisimman paljon ammoniakkia tasapainoseokseen tarvitset mahdollisimman korkean paineen. 200 ilmakehää on korkeapaine, mutta ei hämmästyttävän korkea.
Rate considerations
paineen lisääminen tuo molekyylit lähemmäksi toisiaan., Tässä nimenomaisessa tapauksessa se lisää niiden mahdollisuuksia osua ja pysyä katalyytin pinnalla, jossa ne voivat reagoida. Mitä suurempi paine, sitä parempi kaasureaktion nopeus.
Taloudelliset näkökohdat
Erittäin korkeat paineet ovat hyvin kalliita tuottaa kahdesta syystä.
Sinun täytyy rakentaa erittäin vahva putket ja suojarakennukset kestää erittäin suurta painetta. Se nostaa pääomakustannuksia, kun tehdas rakennetaan.
Korkeapaineet maksavat paljon tuottamisesta ja ylläpidosta., Se tarkoittaa, että laitoksen käyttökustannukset ovat erittäin korkeat.
kompromissi,
200 tunnelmia on kompromissi paine valitaan taloudellisin perustein. Jos käytetty paine on liian korkea, sen tuottamisesta aiheutuvat kustannukset ylittävät hinnan, jonka voit saada tuotetusta ylimääräisestä ammoniakista.
katalysaattori
Tasapaino näkökohdat
katalysaattori ei ole mitään vaikutusta siihen asentoon tasapainon. Katalyytin lisääminen ei tuota suurempaa ammoniakkiprosenttia tasapainoseoksessa. Sen ainoa tehtävä on nopeuttaa reaktiota.,
Korko näkökohdat
ilman katalyyttiä reaktio on niin hidas, että käytännössä mitään reaktiota tapahtuu mitään järkevää aikaan. Katalyytti varmistaa, että reaktio on nopea tarpeeksi dynaaminen tasapaino voidaan perustaa sisällä hyvin lyhyen aikaa, että kaasut ovat todella reaktorissa.
Erottaa ammoniakki
Kun kaasut eivät lähde reaktorista ne ovat kuumia ja erittäin korkea paine., Ammoniakki on helposti nesteytetty paineen alla niin kauan kuin se ei ole liian kuuma, ja niin seoksen lämpötila on laskenut tarpeeksi ammoniakkia kääntyä neste. Typpi ja vety pysyvät kaasuina myös näissä korkeapaineissa, ja ne voidaan kierrättää.
Kysymyksiä, testaa ymmärrystä
Jos tämä on ensimmäinen joukko kysymyksiä, olet tehnyt, lue johdanto-sivulla ennen kuin aloitat. Sinun täytyy käyttää selainpainiketta palataksesi tänne jälkeenpäin.,
kysymyksiä Haber Prosessi
vastauksia
Minne haluaisit mennä?
tasapainovalikkoon . . .
fysikaalisen kemian valikkoon . . .
päävalikkoon . . .