Oppimisen Tavoitteet
- Tietää, fysikaaliset ominaisuudet ionic ja molekyyli-aineita.
olomuoto ja ominaisuudet tietyn yhdisteen riippuu suurelta osin siitä, minkä tyyppistä kemiallisten liimaus se näyttää., Molekyyli-yhdisteitä, joskus kutsutaan 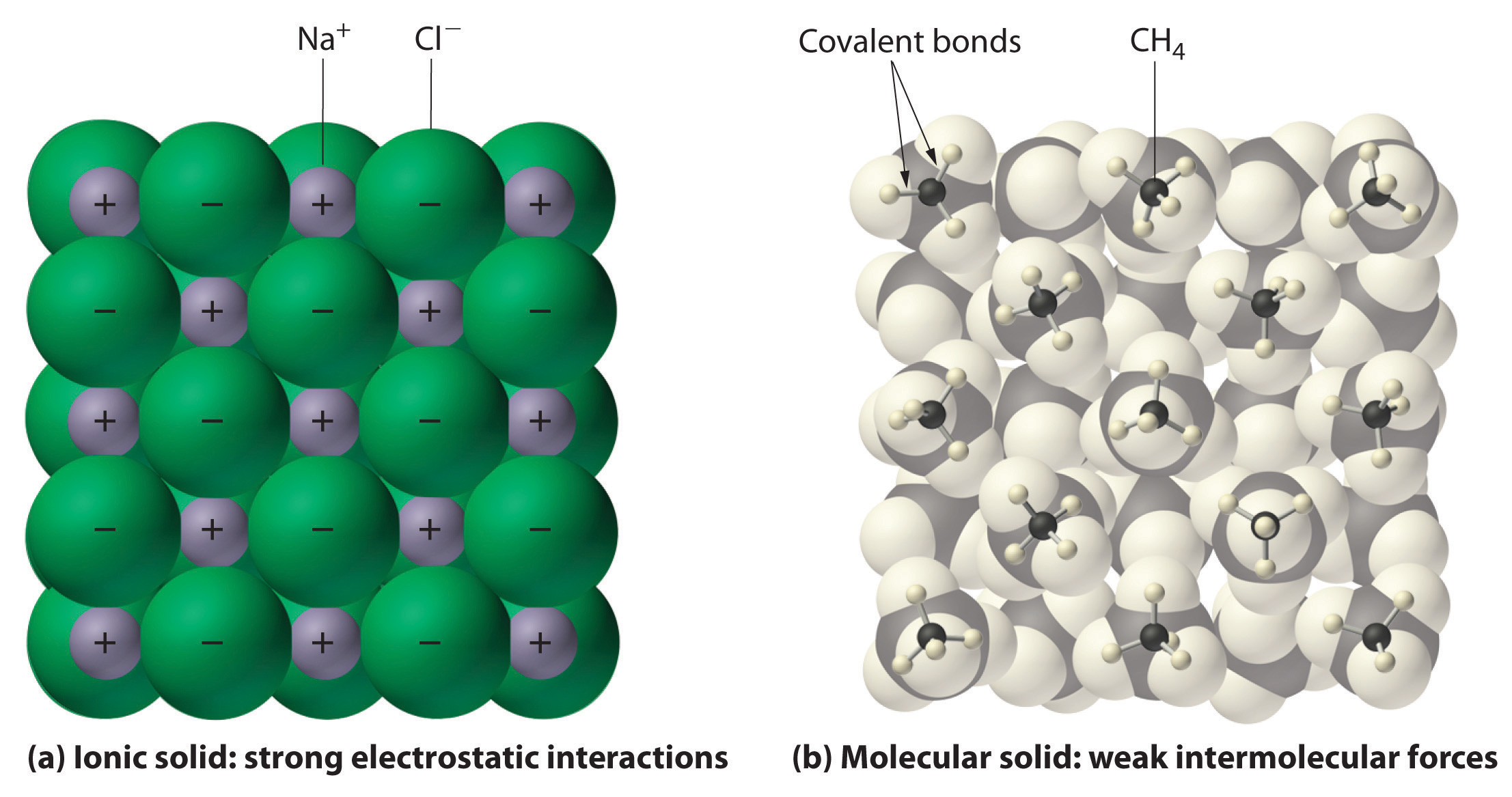 kovalenttisia yhdisteitä, näyttö monenlaisia fyysisiä ominaisuuksia, koska eri molekyylien välisten tärkeimpien nähtävyyksien, kuten erilaisia polar vuorovaikutusta. Molekyyliyhdisteiden sulamis-ja kiehumispisteet ovat yleensä melko matalia ioniyhdisteisiin verrattuna. Tämä johtuu siitä, että energiaa tarvitaan häiritä molekyylien välisten voimien välillä molekyylien on paljon vähemmän kuin energia, joka tarvitaan rikkomaan ionic joukkovelkakirjojen kiteinen ioninen yhdiste (Luku \(\PageIndex{1}\)) ., Ioniset kiintoaineet sulavat tyypillisesti korkeissa lämpötiloissa ja kiehuvat vielä korkeammissa lämpötiloissa. Esimerkiksi natriumkloridi sulaa 801 °C ja kiehuu 1413 °C. (Kuten vertailu, molekyyli yhdiste vesi sulaa 0 °C ja kiehuu 100 °C: seen.). Vesiliukoisuus molekyyli-yhdisteitä on vaihteleva ja riippuu ensisijaisesti tyypistä molekyylien välisten voimien mukana.
kovalenttisia yhdisteitä, näyttö monenlaisia fyysisiä ominaisuuksia, koska eri molekyylien välisten tärkeimpien nähtävyyksien, kuten erilaisia polar vuorovaikutusta. Molekyyliyhdisteiden sulamis-ja kiehumispisteet ovat yleensä melko matalia ioniyhdisteisiin verrattuna. Tämä johtuu siitä, että energiaa tarvitaan häiritä molekyylien välisten voimien välillä molekyylien on paljon vähemmän kuin energia, joka tarvitaan rikkomaan ionic joukkovelkakirjojen kiteinen ioninen yhdiste (Luku \(\PageIndex{1}\)) ., Ioniset kiintoaineet sulavat tyypillisesti korkeissa lämpötiloissa ja kiehuvat vielä korkeammissa lämpötiloissa. Esimerkiksi natriumkloridi sulaa 801 °C ja kiehuu 1413 °C. (Kuten vertailu, molekyyli yhdiste vesi sulaa 0 °C ja kiehuu 100 °C: seen.). Vesiliukoisuus molekyyli-yhdisteitä on vaihteleva ja riippuu ensisijaisesti tyypistä molekyylien välisten voimien mukana.
Kuva \(\PageIndex{1}\) Vuorovaikutus Ioni-ja Kovalenttinen Kiintoaineita.,
(a) positiivisesti ja negatiivisesti varautuneita ioneja ionic kiinteä, kuten
natriumkloridi (NaCl) pidetään yhdessä voimakas sähköstaattinen vuorovaikutus.
(b) tässä edustus pakkaus metaania (CH4) molekyylien kiinteä metaania,
prototypical molekyyli kiinteä, metaani molekyylit pysyvät yhdessä
kiinteä vain suhteellisen heikko molekyylien välisten voimien, vaikka
atomien kunkin metaani-molekyylin pidetään yhdessä vahva kovalenttisten joukkovelkakirjojen.,
Koska molekyyli yhdisteet koostuvat neutraaleja molekyylejä, niiden sähkönjohtavuus on yleensä melko huono, joko kiinteässä tai nestemäisessä olomuodossa. Kiinteässä muodossa, ioninen yhdiste ei ole sähköä johtava, koska sen ionit eivät pysty virtaus (”sähkö” on virtaus varautuneita hiukkasia). Kun sulaa, kuitenkin, se voi johtaa sähköä, koska sen ionit pystyvät liikkumaan vapaasti läpi neste (Luku \(\PageIndex{2}\); Video \(\PageIndex{1}\)).,

Kuva \(\PageIndex{2}\) natriumkloridi sulaa 801 °C ja johtaa sähköä, kun sulaa. (luotto: muuttaminen työn Mark Blaser ja Matt Evans)
Johtavuus on Sula Suola,
Video \(\PageIndex{1}\) Katso tämä video nähdä, sekoitus suolat sulavat ja sähköä.
alla oleva taulukko tiivistää osan ioni-ja molekyyliyhdisteiden eroista.,>
vesiliukoisuus
Yksi tyyppi molecular yhdiste käyttäytyy aivan eri tavalla kuin se on kuvattu toistaiseksi., Kovalenttinen verkko kiinteä aine on yhdiste, jossa kaikki atomit ovat liitetty toisiinsa kovalenttisten joukkovelkakirjojen. Timantti koostuu kokonaan hiiliatomeista, joista kukin on sitoutunut neljään muuhun hiiliatomiin tetraedrisessa geometriassa. Kovalenttisen verkkojäämän sulattaminen ei toteudu voittamalla suhteellisen heikkoja intermolekulaarisia voimia. Pikemminkin, kaikki kovalenttisten joukkovelkakirjojen on rikki, prosessi, joka vaatii erittäin korkeita lämpötiloja. Timantti ei sula lainkaan. Sen sijaan, se höyrystyy bensa lämpötiloissa yli \(3500^\text{o} \text{C}\).,
Tiivistelmä
- fyysiset ominaisuudet materiaali vaikuttaa molekyylien välisten voimien tilalla molekyylit yhdessä.
- Ioniyhdisteet muodostavat yleensä kovaa kiteistä kiintoainetta, jolla on korkeat sulamispisteet. Kovalenttinen molekyyliyhdisteitä, sen sijaan, koostuu erillisistä molekyyleistä, pitää yhdessä heikot molekyylien välisten voimien ja voivat olla kaasuja, nesteitä tai kiinteitä aineita huoneen lämpötilassa ja paineessa.
- ioniyhdisteet sulassa muodossa tai liuoksessa voivat johtaa sähköä, kun taas molekyyliyhdisteet eivät..,
Avustajat
-
Marisa Alviar-Agnew (Sacramento City College)
-
Paul Kukkia (University of North Carolina – Pembroke), Klaus Theopold (University of Delaware) ja Richard Langley (Stephen F. Austin State University) kanssa edistävät tekijät. OpenStax Collegen tuottama oppikirja-sisältö on lisensoitu Creative Commons Attribution License 4.0-lisenssillä. Lataa ilmaiseksi osoitteesta http://cnx.org/contents/85abf193-2bd…[email protected]).,
-
CK-12 Säätiö, jonka Sharon Bewick, Richard Parsons, Therese Forsythe, Terrilyn Robinson, ja Jean Dupon.