sustitución nucleofílica del grupo hidroxilo
el comportamiento químico de los haluros de alquilo se puede utilizar como referencia para descubrir reacciones análogas de sustitución y eliminación de alcoholes. La principal diferencia, por supuesto, es un cambio en el anión saliente de haluro a hidróxido. Debido a que el oxígeno es ligeramente más electronegativo que el cloro (3.5 vs.2.8 en la escala de Pauling), se espera que el enlace C-o sea más polar que un enlace C-Cl., Además, una medida independiente de las características electrofílicas de los átomos de carbono a partir de sus cambios químicos de RMN (tanto 13C como protones Alfa) indica que los sustituyentes de oxígeno y cloro ejercen una influencia similar de retiro de electrones cuando se unen a átomos de carbono hibridados sp3. A pesar de esta prometedora evidencia de antecedentes, los alcoholes no experimentan las mismas reacciones SN2 comúnmente observadas con haluros de alquilo. Por ejemplo, la rápida reacción SN2 del 1-bromobutano con cianuro de sodio, que se muestra a continuación, no tiene paralelo cuando el 1-butanol se trata con cianuro de sodio., De hecho, el alcohol etílico se usa a menudo como solvente para reacciones de sustitución de haluro de alquilo como esta.
CH3CH2CH2CH2–Br + Na(+) NC(–)  CH3CH2CH2CH2–CN + Na(+) Br(–)
CH3CH2CH2CH2–CN + Na(+) Br(–)
CH3CH2CH2CH2–OH + Na(+) NC(–)  Ninguna Reacción
Ninguna Reacción
El factor clave aquí es el de la estabilidad de la salida de aniones (bromuro vs hidróxido)., HBr es un ácido mucho más fuerte que el agua (por más de 18 órdenes de magnitud), y esta diferencia se refleja en las reacciones que generan sus respectivas bases conjugadas. La base más débil, el bromuro, es más estable, y su liberación en una reacción de sustitución o eliminación es mucho más favorable que la del ion hidróxido, una base más fuerte y menos estable.
un paso claro para mejorar la reactividad de los alcoholes en las reacciones SN2 sería modificar el grupo funcional-OH de una manera que mejore su estabilidad como anión saliente., Una de estas modificaciones es conducir la reacción de sustitución en un ácido fuerte, convirtiendo-OH a-OH2 (+). Debido a que el ion hidronio (H3O (+)) es un ácido mucho más fuerte que el agua, su base conjugada (H2O) es un mejor grupo saliente que el ion hidróxido. El único problema con esta estrategia es que muchos nucleófilos, incluido el cianuro, son desactivados por protonación en ácidos fuertes, eliminando efectivamente el co-reactivo nucleofílico requerido para la sustitución., Los ácidos fuertes HCl, HBr y HI no están sujetos a esta dificultad porque sus bases conjugadas son buenos nucleófilos y son bases aún más débiles que los alcoholes. Las siguientes ecuaciones ilustran algunas reacciones de sustitución de alcoholes que pueden ser afectados por estos ácidos. Al igual que con los haluros de alquilo, la sustitución nucleofílica de 1º-alcoholes procede por un mecanismo SN2, mientras que los 3º-alcoholes reaccionan por un mecanismo SN1. Las reacciones de 2º-alcoholes pueden ocurrir por ambos mecanismos y a menudo producen algunos productos reordenados., Los números entre paréntesis junto a las fórmulas de ácido mineral representan el porcentaje de peso de una solución acuosa concentrada, la forma en la que estos ácidos se utilizan normalmente.
aunque estas reacciones a veces se conocen como» catalizadas por ácido», esto no es estrictamente correcto. En la transformación general, un ácido HX fuerte se convierte en agua, un ácido muy débil, por lo que se requiere al menos una cantidad estequiométrica de HX para una conversión completa de alcohol a haluro de alquilo., La necesidad de utilizar cantidades equivalentes de ácidos muy fuertes en esta reacción limita su utilidad a los alcoholes simples del tipo mostrado arriba. Por supuesto, los alcoholes con grupos sensibles a los ácidos no toleran dicho tratamiento. Sin embargo, la idea de modificar el grupo funcional-OH para mejorar su estabilidad como anión saliente puede ser perseguida en otras direcciones. El siguiente diagrama muestra algunas modificaciones que han demostrado ser efectivas. En cada caso el grupo hidroxilo se convierte en un éster de un ácido fuerte. Los dos primeros ejemplos muestran los ésteres de sulfonato descritos anteriormente., Los ejemplos tercero y cuarto muestran la formación de un éster de fosfito (X representa los bromos restantes o sustituyentes adicionales de alcohol) y un éster de clorosulfito, respectivamente. Todos estos grupos salientes (de color azul) tienen ácidos conjugados que son mucho más fuertes que el agua (de 13 a 16 potencias de diez); por lo tanto, el anión saliente es correspondientemente más estable que el ion hidróxido. Los compuestos mesilato y tosilato son particularmente útiles porque pueden usarse en reacciones de sustitución con una amplia variedad de nucleófilos., Los productos intermedios producidos en las reacciones de alcoholes con tribromuro de fósforo y cloruro de tionilo (los dos últimos ejemplos) rara vez se aíslan, y estas reacciones continúan produciendo productos de bromuro de alquilo y cloruro.
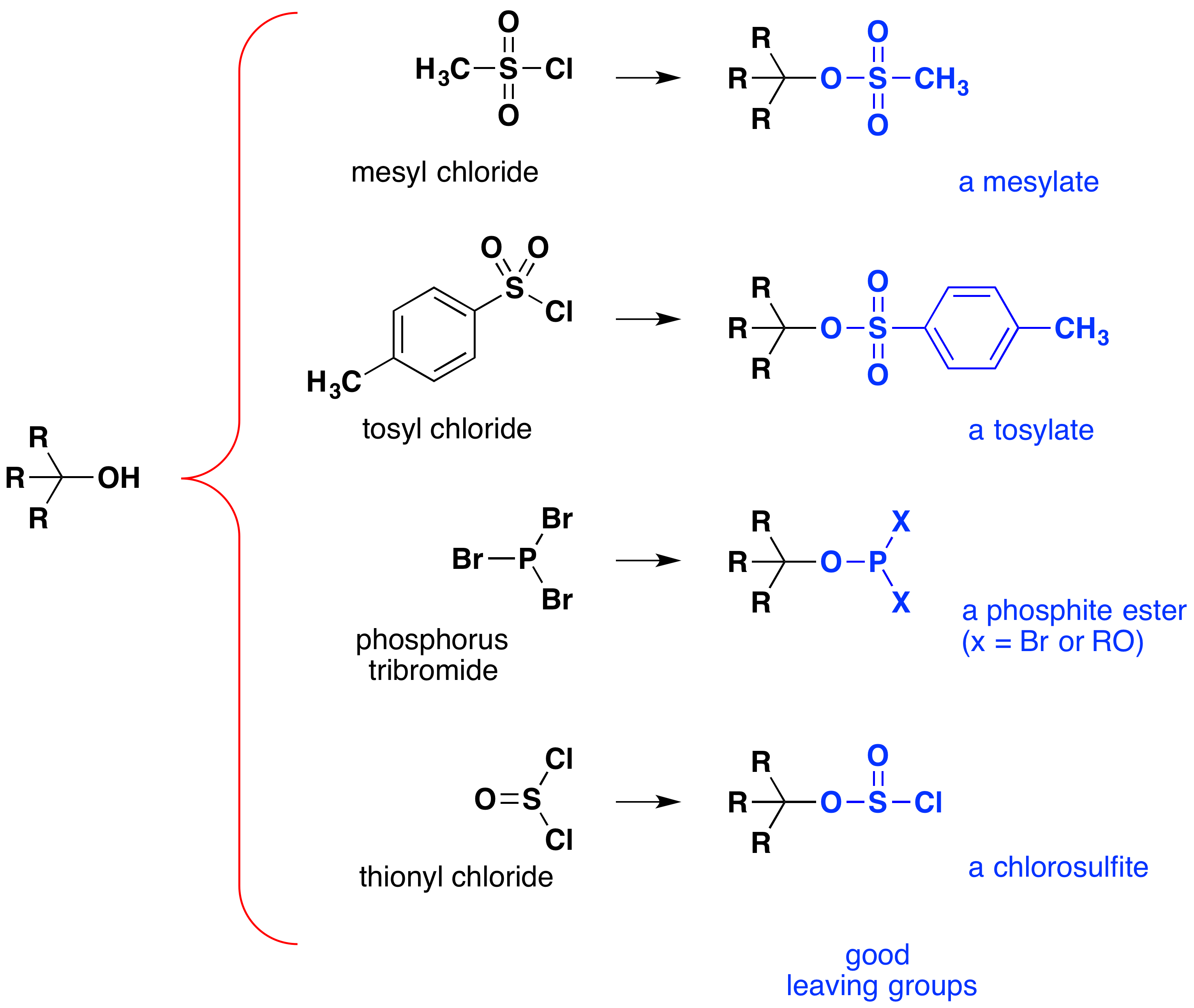
la importancia de los ésteres intermedios de sulfonato en las reacciones generales de sustitución nucleofílica de los alcoholes puede ilustrarse mediante la siguiente conversión de 1-butanol a pentanenitrilo (cianuro de butilo), una reacción que no ocurre solo con el alcohol., Los haluros de fósforo y tionilo, por otro lado, solo actúan para convertir los alcoholes a los haluros de alquilo correspondientes.,
| CH3CH2CH2CH2–OH + CH3SO2Cl | pyridine
|
CH3CH2CH2CH2–OSO2CH3 | Na(+) CN(–)
|
CH3CH2CH2CH2–CN + CH3SO2O(–) Na(+) |
Some examples of alcohol substitution reactions using this approach to activating the hydroxyl group are shown in the following diagram., Los dos primeros casos sirven para reforzar el hecho de que los derivados de ésteres de sulfonato de alcoholes pueden reemplazar los haluros de alquilo en una variedad de reacciones SN2. Los dos casos siguientes demuestran el uso del tribromuro de fósforo en la conversión de alcoholes en bromuros. Este reactivo puede utilizarse sin base añadida (por ejemplo, piridina) porque el producto ácido fosforoso es un ácido más débil que el HBr. El tribromuro de fósforo se usa mejor con 1º-alcoholes porque los 2º-alcoholes a menudo producen subproductos de reordenamiento resultantes de reacciones SN1 competidoras., Tenga en cuenta que el oxígeno del éter en la reacción 4 no se ve afectado por este reactivo, mientras que la síntesis alternativa utilizando HBR concentrado escinde los éteres. El tricloruro de fósforo (PCl3) convierte alcoholes en cloruros de alquilo de manera similar, pero el cloruro de tionilo es generalmente preferido para esta transformación porque los productos inorgánicos son gases (SO2 & HCl). El triyoduro de fósforo no es estable, pero puede generarse in situ a partir de una mezcla de fósforo rojo y yodo y actúa para convertir alcoholes en yoduros de alquilo., El último ejemplo muestra la reacción del cloruro de tionilo con un alcohol quiral de 2º. La presencia de una base orgánica como la piridina es importante porque proporciona una concentración sustancial de iones cloruro necesaria para la reacción final SN2 del intermedio de clorosufita., En ausencia de una base, los clorosufitos se descomponen al calentarse para producir el cloruro de alquilo esperado con retención de configuración
los alcoholes terciarios no se usan comúnmente para reacciones de sustitución del tipo discutido aquí porque las rutas de reacción SN1 y E1 son dominantes y difíciles de controlar.

la importancia de los ésteres de sulfonato como intermediarios en muchas reacciones de sustitución no puede ser exagerada., Una prueba rigurosa de la inversión configuracional que ocurre en el sitio de sustitución en reacciones SN2 hace uso de tales reacciones. Un ejemplo de tal prueba se muestra a continuación. En la siguiente tabla se indican las abreviaturas de los derivados sulfonílicos más utilizados.
| Sulfonil Grupo | CH3SO2– | CH3C6H4SO2– | BrC6H4SO2– | CF3SO2– |
|---|---|---|---|---|
| Nombre & Abbrev., | Mesyl o Ms | Tosil o Ts | Brosyl o B | Trifyl o Tf |
la Inversión de la Prueba

Para una discusión más completa de hidroxilo reacciones de sustitución y una descripción de otras selectivo métodos para esta transformación, haga Clic Aquí.
colaboradores
- William Reusch, Profesor Emérito (Michigan State U.,), Virtual Textbook of Organic Chemistry