la fibrilación auricular no valvular (FANV) es la arritmia más frecuente en España. La incidencia está estrechamente relacionada con la edad, con una prevalencia cercana al 25% en pacientes mayores de 80 años.1 entre los muchos procesos asociados a la FANV, el accidente cerebrovascular de origen cardioembólico es probablemente la complicación más grave, ya que conduce a altas tasas de discapacidad y mortalidad.,2 otro problema asociado a la fibrilación auricular es la necesidad de anticoagulación oral (ACO) para prevenir eventos cardioembólicos. Esta necesidad crece con la edad avanzada, ya que el riesgo de un evento es aún mayor.1 Además, el riesgo de complicaciones asociadas a la terapia anticoagulante, especialmente de sangrado, también aumenta en estos pacientes.3 Actualmente, la oclusión percutánea de la orejuela auricular izquierda (LAA) es una alternativa para los pacientes con FANV y contraindicaciones al tratamiento con ACO.,4,5
anticoagulación ORAL: eficacia y limitaciones
La anticoagulación con antagonistas de la vitamina K se considera el tratamiento estándar para la FANV. Los principales problemas con estos medicamentos son el aumento del riesgo de sangrado, la necesidad de chequeos regulares, la interacción con alimentos u otros medicamentos y la inestabilidad de la acción de los medicamentos en algunos casos. Se estima que entre el 30% y el 50% de los pacientes indicados para ACO no los reciben.6 Con la introducción de nuevos anticoagulantes tales como dabigatrán,7 apixaban,8 y rivaroxaban,9 el manejo de estos pacientes podría cambiar., Cualquiera que sea el caso, y a pesar de su perfil de acción más estable y seguro, el riesgo hemorrágico, con una tasa anual de entre el 2,1% y el 3,6%, sigue siendo el principal talón de Aquiles de estos nuevos agentes (tabla). De hecho, registros más recientes indican que la incidencia de eventos cardioembólicos y hemorragia secundaria a dabigatrán podría ser similar a la de warfarina.10 a pesar de la introducción de nuevos anticoagulantes, el porcentaje de pacientes indicados para ACO pero que no reciben tratamiento se mantiene en torno al 40%.,11 ante la mala adhesión a la terapia y el riesgo persistente de hemorragia, la necesidad de alternativas a la terapia anticoagulante se ha convertido en una prioridad para estos pacientes.
apéndice auricular izquierdo: función, Anatomía e indicaciones para la oclusión
el LAA es un remanente embriológico y su función principal es controlar el volumen sanguíneo. Se encuentra muy cerca de la arteria circunfleja izquierda, bordeando En el nivel superior con la vena pulmonar superior izquierda y en el nivel inferior con la válvula mitral., La morfología de LAA es extraordinariamente heterogénea de un paciente a otro y a menudo hay más de un lóbulo. En el ritmo sinusal, el LAA es una estructura contráctil que vacía su contenido en cada latido del corazón. En la fibrilación auricular, el LAA pierde su capacidad contráctil y se dilata, lo que lleva a una desaceleración del flujo sanguíneo, con el consiguiente aumento del riesgo de trombosis. En los estudios de patología de pacientes con FANV, el 91% de los trombos localizados en la aurícula izquierda se encuentran en la AI., Esto ha llevado a creer que la oclusión percutánea de LAA podría ser una estrategia eficaz para prevenir el riesgo cardioembólico en pacientes con FANV.
la oclusión percutánea de LAA se encuentra todavía en su fase inicial y aún deben pasar algunos años antes de que podamos obtener una visión más fiable de su papel en pacientes con FANV. Aunque, en el futuro, pueda constituir una alternativa real para los pacientes sin contraindicaciones para la ACO, actualmente su uso debe reservarse a aquellos pacientes con contraindicaciones para la terapia anticoagulante, tal y como recomiendan las guías europeas (indicación IIb).,5 de hecho, la mayoría de los procedimientos en pacientes que reciben tratamiento anticoagulante son remitidos por el servicio de Neurología después de un episodio de sangrado intracraneal, o por Gastroenterología después de la observación de sangrado digestivo recurrente sin causa tratable. La falta de alternativas válidas a la ACO para prevenir el riesgo cardioembólico, que generalmente es alto, ya que se trata de pacientes de mayor edad con múltiples patologías, hace que la oclusión de LAA sea una opción muy atractiva para estos pacientes., El cociente internacional normalizado lábil o la aparición de un evento cardioembólico a pesar del tratamiento con ACO y el adecuado cociente internacional normalizado son otros contextos en los que la oclusión percutánea de AIL podría estar justificada. En cualquier caso, se necesitan decisiones multidisciplinarias e individualizadas para evaluar tanto el riesgo cardioembólico como hemorrágico y otros factores esenciales como la efectividad del tratamiento, la fragilidad del paciente o la adherencia al tratamiento, especialmente con ACO.
dispositivos percutáneos de oclusión de la orejuela izquierda
el dispositivo PLAATO™ fue el primer oclusor percutáneo de LAA (Fig. 1)., A pesar de los buenos resultados preliminares en términos de eficacia y seguridad, el programa de desarrollo se suspendió y el dispositivo desapareció del mercado.
actualmente, los dos dispositivos más utilizados en todo el mundo son el sistema Watchman™ (Boston Scientific; Boston, Massachusetts, Estados Unidos) y el enchufe cardíaco Amplatzer™ (ACP) (St.Jude Medical; Minneapolis, Minnesota, Estados Unidos) (Fig. 1). Al igual que el sistema PLAATO™, ambos se implantan a través de la vía transeptal utilizando el acceso de la vena femoral., Ambas prótesis son altamente flexibles y tienen un sistema de guías estabilizadoras que se anclan a la pared de LAA y así evitan la embolización. La principal diferencia entre los dos dispositivos, sin embargo, está en su forma. El sistema Watchman™ se implanta a 10 mm del ostium de Laa, y por lo tanto no lo cubre; el ACP contiene un lóbulo que se implanta a 10-15 mm del ostium y un disco que cubre completamente el ostium de laa (Fig. 2). Una segunda generación de ACP llamada Amplatzer™ Amulet™ ha aparecido recientemente en el mercado. El dispositivo Amulet™ (Fig., 1) también tiene forma de lóbulo y tiene un disco como el ACP, pero tiene modificaciones que facilitan la preparación e implantación del dispositivo y, al mismo tiempo, minimizan el riesgo de embolización y trombosis.
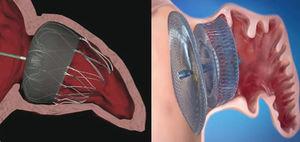
posición de los dispositivos Watchman™ y Amplatzer™ Cardiac Plug después de la implantación en la orejuela auricular izquierda., Dispositivo Watchman™ implantado a 10 mm del ostium de la orejuela izquierda (izquierda) y dispositivo de tapón cardíaco Amplatzer™ con el lóbulo implantado a 10 mm del ostium y el disco que cubre la entrada a la orejuela izquierda (derecha).
numerosos registros dan fe de la eficacia y seguridad del sistema Watchman™ y del ACP, pero ambos requieren una curva de aprendizaje de implantación nada desdeñable., El estudio PROTECT AF12, el único estudio aleatorizado en el que se comparó la warfarina con la oclusión A LAA (Watchman™) en pacientes con FANV, mostró que la oclusión A LAA no es menos exitosa que la warfarina en relación con el objetivo principal (accidente cerebrovascular combinado, embolia sistémica y muerte cardiovascular o inexplicable), pero mostró una tasa preocupante de eventos periprocedimiento, con una incidencia del 4,4% de derrame pericárdico grave., Este problema inicial se atribuyó a la curva de aprendizaje del operador: con la experiencia del operador, la tasa de complicaciones disminuyó y el porcentaje de implantes exitosos mejoró significativamente. Actualmente (para ambos dispositivos) más del 95% de los implantes son generalmente exitosos y la tasa de derrame pericárdico grave es
consideraciones técnicas
la técnica de oclusión percutánea de LAA requiere de un equipo con experiencia en enfermedad congénita/estructural., Aunque algunos grupos utilizan solo la ecocardiografía intracardiaca, o incluso el control angiográfico, para guiar el procedimiento y evitar la intubación del paciente, la mayoría de los centros utilizan la ecocardiografía transesofágica (ETE) bajo anestesia general. Estructuralmente, el LAA tiene paredes muy finas y una morfología heterogénea que puede ocultar microtrombosis desde el TEE. La experiencia del operador es esencial para minimizar la manipulación dentro de la LAA y así reducir el riesgo de perforación y embolia periprocedimiento., Dos de los factores más importantes que minimizan la manipulación en la AEL son los siguientes: a) una punción transeptal posterior baja que facilita un abordaje frontal de la AEL, y b) Un estudio detallado de la AEL, si es posible con ete y angiografía, con el fin de establecer la morfología de la AEL y obtener medidas precisas que faciliten la selección del tamaño del oclusor. Se recomienda que las mediciones se realicen con un volumen sanguíneo normal, ya que el tamaño de LAA puede variar significativamente en función del nivel de hidratación del paciente., Durante el procedimiento, los pacientes tienden a deshidratarse; por lo tanto, se recomienda determinar la presión de la aurícula izquierda y administrar líquido para mantener >10 mmHg de presión antes de tomar las mediciones.
Este es un procedimiento relativamente nuevo y, a pesar de que la ETE es el estándar de imagen, el modo de imagen ideal sigue siendo desconocido. La morfología de LAA es ovalada en el 80% de los pacientes, por lo que los diámetros suelen variar debido a los ejes cortos y largos. Esta diferencia puede pasar desapercibida con las técnicas de imagen de 2 dimensiones., Al igual que en procedimientos como el reemplazo percutáneo de la válvula aórtica, la ETE tridimensional o la tomografía cardíaca pueden proporcionar información espacial que puede ayudar a optimizar la estrategia de implantación y la selección del tamaño del dispositivo.
la importancia de las fugas periprotésicas durante el seguimiento sigue siendo incierta. Un subanálisis del estudio PROTECT AF no encontró relación entre las fugas y la aparición de eventos clínicos., Por el contrario, en estudios de resultados de la cirugía coronaria, la escisión incompleta de LAA en pacientes con oclusión quirúrgica profiláctica de LAA se ha asociado con una mayor tasa de eventos cardioembólicos. A medida que esperamos nuevos estudios disponibles que puedan o no confirmar esta relación, debemos tratar de evitar fugas periprotésicas. Por lo tanto, se recomienda que el dispositivo sea algo más grande que la ete y las medidas angiográficas sugerirían, ya que esto permite reducir la tasa de fugas residuales sin aumentar el riesgo de ruptura de la pared de la AEL.,13
Las recomendaciones antitrombóticas Postprocedimiento son otro tema controvertido. En el estudio PROTECT AF, la ACO se administró durante 45 días después del implante y se suspendió si la ETE mostraba una oclusión adecuada de LAA.12 recientemente, el estudio ASAP demostró que el tratamiento con ACO durante 45 días puede sustituir a la doble terapia antiagregante plaquetaria (100 mg/día de ácido acetilsalicílico y 75 mg/día de clopidogrel).14 actualmente, la mayoría de los centros recomiendan antiagregantes plaquetarios duales durante 1 a 3 meses y monoterapia antiagregante indefinida., La trombosis del dispositivo es una complicación poco frecuente, pero se ha descrito tanto en los dispositivos Watchman™ como en los ACP. Aunque esta complicación se resuelve a las 2 semanas de tratamiento anticoagulante en la mayoría de los pacientes, el riesgo potencial de embolia debido a la migración del trombo la convierte en una de las complicaciones más temidas., En la única serie española reportada, se observó una tasa alarmante de trombosis del dispositivo en el 14% de los pacientes, en contraste con los 15 esta diferencia en el porcentaje de trombosis podría deberse a una diferencia en la sensibilidad de detección: en el registro español, el protocolo de seguimiento de la ETE fue mucho más largo (24 h y 1, 3, 6 y 12 meses) que en la mayoría de los centros estudiados, donde se utilizó la ETE durante 3 a 6 meses.,15 dado que la mayoría de los casos de trombosis ocurrieron a los 3 meses y todos se resolvieron mediante la administración de heparina sódica o enoxaparina durante 2 semanas, determinar la viabilidad de la terapia anticoagulante durante 3 meses o un seguimiento más exhaustivo podría ser una opción Futura, una vez que se haya aclarado la verdadera incidencia de trombosis del dispositivo. En cualquier caso, la evaluación multidisciplinaria e individualizada es necesaria en pacientes de este tipo, que a veces presentan un riesgo hemorrágico tan alto que incluso períodos cortos de anticoagulación podrían estar contraindicados.,
conclusiones y perspectivas de futuro
aunque la FANV ya es una de las enfermedades más frecuentes en nuestra sociedad, su prevalencia va a aumentar en los próximos años debido al envejecimiento progresivo de la población. Por diferentes razones, entre el 30% y el 50% de los pacientes indicados para ACO no los toman. Hoy en día, la oclusión de LAA constituye una alternativa para los pacientes con FANV y contraindicaciones para la terapia anticoagulante., La oclusión de LAA es un procedimiento eficiente y seguro, pero requiere un equipo con experiencia en cardiología intervencionista estructural y se asocia con una curva de aprendizaje sustancial para el operador.
en el futuro, la oclusión de LAA podría ser una alternativa al tratamiento de la ACO para todos los pacientes con FANV. Aunque el estudio PROTECT AF ya ha demostrado que la eficacia de la oclusión de la LAA no es menor que la de la terapia anticoagulante, la curva de aprendizaje inicial condicionó una alta tasa de complicaciones periprocedimiento., Dos nuevos estudios aleatorizados-PREVAIL y ACP—compararán específicamente la oclusión de LAA con el tratamiento de la ACO en pacientes con FANV una vez superada la curva de aprendizaje del procedimiento inicial. El estudio PREVAIL compara el dispositivo Watchman™ con warfarina, y ACP compara el dispositivo ACP con warfarina y dabigatrán. Si los resultados de ambos estudios muestran que la oclusión de la LAA no es menos exitosa que la terapia anticoagulante en pacientes con FANV, el uso del procedimiento podría extenderse y podría convertirse en una alternativa a la terapia anticoagulante para pacientes con un perfil de riesgo más bajo.,
conflictos de intereses
Xavier Freixa es proctor de St. Jude Medical.