Introduction
durante el invierno, a veces los dermatólogos reciben pacientes asintomáticos, sin lesiones específicas que no sean, quizás, alguna decoloración post-inflamatoria, pero con una necesidad desesperada de ayuda. Comienzan a contar la historia de una serie de pápulas o vesículas que aparecen en su piel después de la primera exposición intensa al sol del año., Junto con las lesiones, un terrible picor comienza y aumenta con la propagación de la enfermedad, después de la siguiente exposición al sol, a veces agravado por una especie de sensación de ardor. Sin embargo, estas personas son modelos buscadores de sol y continúan disfrutando del sol durante todo el verano, esperando que las pápulas se desvanezcan y desaparezcan gradualmente. Las principales preguntas son: ¿Cómo puedo prevenir esto? ¿Por qué tengo este problema desde hace» 5 » años, pero nunca lo había tenido antes?,
lo más probable es que estemos tratando con erupción polimórfica de luz (PLE) y, siguiendo las peticiones de nuestros pacientes, la investigación médica se ha centrado principalmente en estrategias de prevención que hoy en día son bastante satisfactorias. Por otro lado, la segunda pregunta, y ciertamente menos explorada, sigue sin estar clara, a menos que se hayan agregado varias piezas a este rompecabezas bastante complicado. El objetivo de esta breve revisión es retomar los avances más recientes en los posibles mecanismos de EPL y los protocolos más utilizados para la prevención o el tratamiento.
patofisiología de la erupción polimórfica de luz: ¿Qué hay de nuevo?,
PLE es el trastorno fotosensible más común, caracterizado por una erupción intermitente de pápulas eritematosas pruríticas no cicatrizantes, vesículas o placas (Figura 1) que se desarrollan a las pocas horas de la exposición de la piel del paciente a la radiación ultravioleta (UVR). La enfermedad depende de la susceptibilidad genética, así como del componente ambiental, como el tipo de exposición. La EPP parece agruparse en familias: se ha estimado que la prevalencia de EPP fue de 21 y 18% en gemelos monocigóticos y dicigóticos, respectivamente (1)., Además, un historial familiar positivo de EPP en parientes de primer grado estuvo presente en el 12% de los pares gemelos afectados respecto al 4% de los pares gemelos no afectados (p < 0.0001). La concordancia probandwise en monocigóticos fue superior que en pares gemelos dicigóticos (0.72 vs. 0.30, respectivamente), demostrando un fuerte efecto genético (1). Muchos genes de interés potencial en la patogénesis de la EPL han sido investigados con resultados generalmente poco gratificantes., Utilizando el análisis de segregación, se ha estimado que el 72% de la población del Reino Unido tiene un alelo de susceptibilidad a la PLE de baja penetrancia (2).
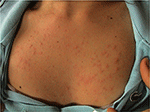
la Figura 1. Cuadro clínico de erupción polimórfica de luz en una mujer joven.
El fracaso de la Apoptosis: los posibles antígenos Neo Fotoinducidos
en un análisis reciente de expresión genómica, solo 16 genes se expresaron diferencialmente entre PLE y controles sanos después de la irradiación UV respecto al control (3)., De estos genes, 14 mostraron menor expresión en pacientes con EPP, mientras que dos resultaron sobreexpresados. Entre los 14 genes con menor expresión en PLE se encuentran: subunidad del complemento 1s (C1s), receptor carroñero B1 (SCARB1) fibronectina (FN1), miembro de la superfamilia de inmunoglobulinas 3 (IGSF3), caspasa-1 (CASP1) y PARAOXONASA 2 (PON2), todos genes asociados con el aclaramiento de células apoptóticas. Se ha supuesto que la modificación de proteínas durante el aclaramiento de células apoptóticas podría conducir a la formación potencial de auto-antígeno (4)., Entonces, la expresión reducida en pacientes con EPL de genes conectados a este proceso podría representar una posible fuente de auto-antígeno, así como una fase crucial en el inicio del proceso autoinmune que promueve la enfermedad (3). De acuerdo con estos hallazgos, Kuhn et al. mostró acumulación de células apoptóticas en pacientes con EPL irradiados con 1,5 dosis mínima de eritema (MED) de UVB, o 60-100 J/cm2 de UVA1, en comparación con los controles (5).,
inmunidad: falla de tolerancia
Los auto-antígenos derivados del aclaramiento ineficiente de las células apoptóticas, son probablemente absorbidos por las células dendríticas (DCs) y presentados a células T naive (citotóxicas y auxiliares) transformadas posteriormente en células T auto-reactivas (6, 7). Este fracaso parcial de la apoptosis contribuye, junto con la inadecuada inmunosupresión tras la exposición UV, al reconocimiento y presentación del antígeno, dando lugar a la manifestación clínica típica de los pacientes con EPP (8)., De hecho, el fracaso de la inmunosupresión normal inducida por UVR se ha demostrado como la principal anomalía inmunológica en la EPL, explicada, inicialmente, por la permanencia de las células de Langerhans (LCs) en la epidermis. Esta sobre-Activación del sistema inmune, que escapa a la tolerancia funcional inducida por UV, es probablemente responsable de la reducción de la prevalencia de cáncer de piel en pacientes con EPP (9). Por otro lado, el mismo mecanismo es culpable del fracaso de la supresión de la dermatitis alérgica de contacto (ACD), después de la exposición UVR (10).,
vía inflamatoria: reacción de hipersensibilidad retardada
los mecanismos inmunológicos implicados en la EPL, con mediadores del sistema inmune innato y adaptativo, son muy similares, ya sea desde el punto de vista histológico o bioquímico, a los de la DCA. En efecto, a principios de los años setenta, Epstein indicó por primera vez la EPL como una reacción de hipersensibilidad de tipo retardado (DTHR) al antígeno cutáneo inducido por UVR indefinido (11). Recientemente, para reforzar este concepto, algunos de los mediadores inflamatorios involucrados en la DCA han sido demostrados también en la EPL., Por ejemplo, la familia IL-1 (12, 13), un grupo creciente de citocinas que desempeñan varios papeles en la regulación inmunitaria y la inflamación (14), implicadas también en la patogénesis de la DCA (12, 15), ha sido explorada también en la EPL (16). IL-36α e IL-36γ, los miembros pro-inflamatorios de la familia IL-1 fueron aumentados en PLE respecto a los controles, como para las muestras de ACD, pero IL-36γ fue mucho mayor en PLE que en ACD (16). Actuando a través del receptor común compuesto por IL-36R e IL-1R/AcP (IL-1RL2), IL-36α, IL-36β e IL-36γ activan NF-kB y MAPKs, promoviendo reacciones inflamatorias., El aumento de IL-36s en la piel y sangre periférica de pacientes con EPL indica la activación de la respuesta inmune local y sistémica, como se encuentra en múltiples afecciones inflamatorias de la piel (15, 17, 18). Probablemente, el vínculo entre la IL-36s y la exposición a la UVR está representado por la señal proinflamatoria paracrina de activación del receptor tipo toll (TLR)-3, debido a la liberación de ARN por los queratinocitos necróticos (19). De hecho, la falla de la limpieza apoptótica en PLE, con abundancia de escombros celulares, podría ser responsable de una amplificación de esta «señal de alerta».,»
además, los IL-36 podrían contribuir a amplificar la señal inmune innata y la consecuente cascada inflamatoria, promoviendo péptidos antimicrobianos (AMPs) (20).
vía inflamatoria: AMPs y microbioma
estos mediadores, conocidos como defensinas (α y β), catelicidina (LL37), ribonucleasa 7 (RNase7) y psoriasin (S100A7), a la luz del desequilibrio inducido por la UVR en queratinocitos y microbioma de la piel, también se han investigado en la EPL (21, 22). Patra et al., han encontrado que la expresión de psoriasin, RNase7, HBD-2, y LL-37 Se incrementó en la piel PLE lesional, mientras que HBD-3 se redujo. Considerando la superficie de la piel como un» mundo multiétnico», sin olvidar el papel crucial de los queratinocitos, no podemos excluir que la liberación de AMPs pueda determinarse mediante la modificación de los componentes del microbioma tras la interacción UV (23). De hecho, el microbioma podría representar la fuente, directa o indirecta, de los antígenos inducidos por UVR aún no detectados que se forman en pacientes con EPL, lo que conduce al daño de los queratinocitos., Como consecuencia, EL LL-37, también inducido por UVB, IFNy, TNF-α, IL-6, podría representar un potencial impulsor indirecto del PLE (23). Puede formar agregados con ácidos autonucleicos capaces de activar pDCs: en psoriasis ha sido reconocido como el autoantígeno principal (24). Aunque en los pacientes con EPL se ha notificado una ausencia completa de CPD (25), existe un entorno autoinmune, y la LL-37 podría desempeñar un papel fundamental, induciendo otras vías inflamatorias. En la figura S1 (material suplementario), los conceptos expresados anteriormente se visualizan en una caricatura.
terapia de erupción de luz polimórfica: ¿Qué hay de nuevo?,
la primera línea de tratamiento para la EPL incluye la evitación del sol, los protectores solares y los corticosteroides tópicos (26). Para todos los pacientes el manejo preventivo es fundamental durante el tiempo soleado, evitando la exposición intensa a UVR y el uso de ropa protectora, así como la aplicación de protector solar, en particular durante la primera exposición del año. Se ha informado que los protectores solares de nueva generación de amplio espectro, con un alto factor de protección solar para UVB (SPF), junto con una protección UVA de mayor longitud de onda, confieren protección total o parcial hasta en el 90% de los pacientes con EPL (27, 28)., El uso de antioxidantes orales y nicotinamida podría representar una medida preventiva válida adicional para estos pacientes. Los efectos beneficiosos de la nicotinamida se han investigado en un ensayo no controlado de 42 pacientes, donde el 60% de ellos informaron la abolición completa de los síntomas al tomar 2-3 g de nicotinamida al día, antes de la exposición al sol (29). Además, se ha demostrado que un extracto del helecho tropical Polypodiumleucotomos [PL) ejerce potentes efectos antioxidantes e inmunomoduladores., Cuando se administró a 480 mg / día antes de la exposición al sol, redujo significativamente las reacciones cutáneas y los síntomas subjetivos (30, 31). En cuanto a los corticosteroides tópicos, aunque no se han realizado ensayos para determinar su eficacia en la EPP, son ampliamente utilizados para reducir la picazón (26). La segunda línea de tratamientos para la EPL incluye corticosteroides sistémicos y fototerapia(quimio) (26). En un ensayo aleatorizado, doble ciego, controlado con placebo (32), los autores sugirieron el uso de 25 mg de prednisolona diariamente durante 4-5 días al inicio de la erupción., Aunque se deben considerar los posibles efectos secundarios a largo plazo de los ciclos repetidos de prednisolona, podría aconsejarse para pacientes que sufren ataques ocasionales de EPL, en ausencia de contraindicaciones. En los casos más leves de EPP, un programa de autoacondicionamiento mediante la exposición a la luz solar en primavera puede ser suficiente (33). Considerando que, en casos más graves, el tratamiento de acondicionamiento/desensibilización supervisado médicamente puede ser más apropiado., Un curso de terapia con psoraleno y UVA (PUVA), fototerapia de banda estrecha (NB)-UVB o de banda ancha (BB)-UVB, generalmente administrada a principios de la primavera, puede ser eficaz, así como el tratamiento profiláctico (26). El protocolo de tratamiento generalmente consiste en un curso de fototerapia / fotoquimioterapia durante 5-6 semanas. Las dosis iniciales dependen de la dosis eritémica mínima (MED) o de la dosis fototóxica mínima (MPD), y con frecuencia son del 50-70% de estos umbrales medidos con incrementos incrementales., Para mantener el beneficio adquirido con la terapia desensibilizante, se recomienda una exposición regular al sol durante todo el verano, de lo contrario el endurecimiento podría perderse dentro de 4-6 semanas. En el tratamiento de la EPL, se debe preferir la NB-UVB a la PUVA (fuerza de la recomendación D; nivel de evidencia 4), debido al menor riesgo de fotocarcinogénesis, no hay riesgo de náuseas u otros efectos secundarios asociados con la ingestión de MOP y no es necesario usar protección ocular después del tratamiento. Sin embargo, se debe considerar la PUVA, antes de otros tratamientos sistémicos, si la NB-UVB ha fracasado o ha desencadenado previamente la erupción., En efecto, como se describe a continuación, se ha demostrado la eficacia para múltiples regímenes de fototerapia (BB-UVB, NB-UVB y PUVA), y los efectos secundarios, en términos de provocación de erupción, eritema y picor se encontraron más comunes con UVB que con PUVA (34). Como se resume en la literatura, la eficacia de PUVA da como resultado una tasa de fotoprotección del 65-100% (34)., Se han realizado múltiples estudios comparativos, pero del único ensayo controlado aleatorizado entre PUVA y NB-UVB más tabletas de placebo, tres veces por semana, durante 5 semanas, no surgió ninguna diferencia significativa en la eficacia, considerando la aparición de PLE o restricción de actividad al aire libre (35). En la revisión retrospectiva de 10 años, reportada por Man et al. (36), 170 pacientes con EPP de moderado a grave recibieron fototerapia PUVA y/o UVB. En detalle, 8 pacientes recibieron PUVA, 128 NB-UVB, 5 BB-UVB y 29 pacientes, que no respondieron satisfactoriamente a NB-UVB, recibieron PUVA al año siguiente., Se realizaron autoevaluaciones de la gravedad y se informó de la frecuencia de los episodios de EPP en las visitas de seguimiento en otoño o durante la primavera siguiente. Se notificó una mejoría buena o moderada en el 88% de los pacientes tratados con PUVA y en el 89% que recibieron UVB. De los pacientes tratados con PUVA y NB-UVB, la mayoría prefirió PUVA. En otro estudio retrospectivo de 14 años en 79 pacientes tratados con fototerapia (37), la eficacia, medida durante el verano siguiente en términos de fotoprotección con remisión completa/parcial, fue del 65% para PUVA, del 82% para BB-UVB y del 83% para UVA sola., En este caso, el tratamiento con PUVA se reservó a las formas de EPL más graves.
los mecanismos por los cuales la fototerapia induce la fotoprotección no se entienden completamente.
sin embargo, en los últimos años se han realizado muchos avances. Además de los efectos bien conocidos sobre la melaninización y el engrosamiento epidérmico de la fototerapia, se informa de una amplia gama de propiedades inmunomoduladoras y antiinflamatorias inducidas por los rayos UV (38)., Tanto la UVB como la UVA modulan la expresión de la molécula de adhesión e inducen mediadores solubles, como la hormona estimulante de los melanocitos a, la IL-10 (que suprime la producción de interferón γ) y la prostaglandina E2, que explican las acciones antiinflamatorias, previniendo la activación de las células T y promoviendo la apoptosis de las células T infiltrantes de la piel (34). Además, se ha demostrado que el fotohardinamiento profiláctico UV en pacientes con EPL restaura la migración del CP inducido por UV desde la epidermis a los ganglios linfáticos que drenan la piel: uno de los eventos celulares clave en la inmunosupresión UV (39)., La tolerancia inducida por el CP está mediada por la liberación de citoquinas inmunosupresoras como la IL-10, y por la interferencia con la maduración e inducción de las células T reguladoras (Tregs) (40). Además, recientemente, se ha reportado un vínculo interesante entre LC, Tregs y vitamina D3. De hecho, se ha demostrado que un pretratamiento tópico a corto plazo de 1 semana con el análogo de la 1,25-dihidroxivitamina D, calcipotriol, disminuyó los síntomas de PLE después de la fotoprovocación experimental posterior (41)., Además, en un estudio Murino, la 1,25-dihidroxivitamina D mostró efectos inmunosupresores comparables a los de la UV (42). Otra interferencia interesante se ha destacado entre LCs y mastocitos. Además de su reconocido papel en la atopia, los mastocitos dérmicos también son responsables de proteger la piel de la inflamación inducida por UVB, promoviendo la inmunosupresión UV (40). Estudios en humanos han demostrado que después de la exposición aguda y crónica a la UVR, el número de mastocitos dérmicos aumenta, junto con la liberación de IL-10., En general, estos datos sugieren un papel potencial de los mastocitos en la EPL y en el mecanismo de fotohardinamiento. De acuerdo con esto, Wolf et al. han informado, por primera vez, que el fotohardinamiento aumenta significativamente la densidad de mastocitos en la dermis papilar de pacientes con EPL (40). Resumiendo, el fotohardinamiento funciona en PLE restaurando la vía inmunosupresora normal de los rayos UV, involucrando múltiples tipos celulares. El tratamiento de tercera línea para la EPL incluye el uso de fármacos inmunosupresores sistémicos, como azatioprina y ciclosporina., Sin embargo, solo se han notificado casos esporádicos de pacientes tratados con éxito en la literatura (43, 44). Además, se han propuesto como tratamientos La hidroxicloroquina, los ácidos grasos omega-3 y el betacaroteno, pero se requieren más ensayos controlados aleatorizados doble ciego para evaluar realmente su eficacia clínica.
conclusiones
debido a la alta prevalencia y creciente incidencia de EPP, asociada a molestias y restricciones en el estilo de vida, es necesario realizar estudios futuros para encontrar nuevas estrategias terapéuticas y / o preventivas., La elección del tratamiento adecuado para la EPP requiere un buen conocimiento de la evolución clínica individual de la enfermedad, junto con la posibilidad de realizar una prueba fotográfica. Se han destacado algunos aspectos nuevos en la posible activación y promoción del proceso inflamatorio.,
al estado actual del conocimiento, a pesar de la identificación de alguna regulación celular crucial involucrada en la restauración de la tolerancia inmune, es difícil sacar conclusiones definitivas sobre la eficacia de varios tratamientos potenciales en la EPL, debido a la falta de estudios adecuados y la dificultad en la evaluación de medidas de resultados. La puntuación clínica para evaluar la gravedad de la EPL (PLESI) (45) sigue siendo un instrumento escasamente utilizado y restringido principalmente a fines de investigación., El estudio más profundo de los mecanismos patogenéticos subyacentes del trastorno permitirá un enfoque de tratamiento más específico.
contribuciones del autor
SL proyectó el manuscrito, seleccionó el material para el artículo, escribió el borrador inicial y corrigió los siguientes borradores del manuscrito. AR participó en la redacción del manuscrito, apoyando nuevas ideas de contenido y estilo.,
Declaración de conflicto de intereses
los autores declaran que la investigación se realizó en ausencia de relaciones comerciales o financieras que pudieran ser interpretadas como un potencial conflicto de intereses.
material suplementario
figura S1. Interacción entre el sistema inmune innato y adaptativo en un contexto de falla de apoptosis en la epidermis. (Símbolo verde) Psoriasin: expresión abundante en las capas espinosas y granulares de la piel PLE. (Símbolo azul) RNase7: expresado principalmente en queratinocitos del estrato granuloso y estrato córneo de lesiones PLE., (Símbolo amarillo) LL-37 Se expresó profundamente en y alrededor de los vasos sanguíneos y glándulas en PLE. (Símbolo de célula violeta) queratinocitos apoptóticos con aclaramiento ineficiente.,hic light eruption; ACD, Allergic contact dermatitis; DTHR, Delayed type hypersensitivity reaction; UVR, Ultraviolet radiation; C1s, Complement 1s subunit; SCARB1, Scavenger receptor B1; FN1, Fibronectin; IGSF3, Immunoglobulin superfamily member 3; CASP1, Caspase-1; PON2, Paraoxonase 2; MED, Minimal Erythema Dose; DCs, Dendritic cells; LCs, Langerhans cells; TLR, Toll like receptor; AMPs, Antimicrobial peptides; SPF, Sun protection factor; PUVA, Psoralen and UVA therapy; NB-UVB, Narrowband; BB-UVB, Broadband UVB; MPD, Minimum phototoxic dose; Tregs, Regulatory T cells; PL, Polypodiumleucotomos.,
2. McGregor JM, Grabczynska S, Vaughan R, Hawk JL, Lewis CM. Genetic modelling of abnormal photosensitivity in families with polymorphic light eruption and actinic prurigo. J Invest Dermatol. (2000) 115:471–6. doi: 10.1046/j.1523-1747.2000.00080.x
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Lembo S, Hawk JLM, Murphy GM, Kaneko K, Young AR, McGregor JM, et al., Aberrant gene expression with deficient apoptotic keratinocyte clearance may predispose to polymorphic light eruption. Br J Dermatol. (2017) 177:1450–3. doi: 10.1111/bjd.15200
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Savill J, Fadok V. Corpse clearance defines the meaning of cell death. Nature (2000) 407:784–8. doi: 10.,1038/35037722
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Kuhn A, Herrmann M, Kleber S, Beckmann-Welle M, Fehsel K, Martin-Villalba A, et al. Accumulation of apoptotic cells in the epidermis of patients with cutaneous lupus erythematosus after ultraviolet irradiation. Arthritis Rheum. (2006) 54:939–50. doi: 10.1002/art.21658
PubMed Abstract | CrossRef Full Text | Google Scholar
6., Savill J, Dransfield I, Gregory C, Haslett C. A blast from the past: clearance of apoptotic cells regulates immune responses. Nat RevImmunol. (2002) 2:965–75. doi: 10.1038/nri957
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Albert ML, Sauter B, Bhardwaj N. Dendritic cells acquire antigen from apoptotic cells and induce class I-restricted CTLs. Nature (1998) 392:86–9. doi: 10.,1038/32183
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Koulu LM, Laihia JK, Peltoniemi HH, Jansén CT. UV-induced tolerance to a contact allergen is impaired in polymorphic light eruption. J Invest Dermatol. (2010) 130:2578–82. doi: 10.1038/jid.2010.181
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Epstein JH. Polymorphous light eruption. J Am Acad Dermatol. (1980) 3:329–43.,
PubMed Abstract | Google Scholar
12. Mattii M, Ayala F, Balato N, Filotico R, Lembo S, Schiattarella M, et al. The balance between pro- and anti-inflammatory cytokines is crucial in human allergic contact dermatitis pathogenesis: the role of IL-1 family members. Exp Dermatol. (2013) 22:813–9. doi: 10.1111/exd.12272
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Dinarello CA., Interleucina-1 en la patogénesis y el tratamiento de enfermedades inflamatorias. Blood (2011) 117: 3720-32. doi: 10.1182/sangre-2010-07-273417
PubMed Abstract | CrossRef Texto Completo | Google Scholar
16. Lembo S, Caiazzo G, Balato N, Monfrecola G, Patra V, Wolf P, et al. Erupción polimórfica de luz y miembros de la familia de IL – 1: ¿hay alguna diferencia con la dermatitis alérgica de contacto? Photochem Photobiol Sci. (2017) 16:1471–9. doi: 10.,1039/c7pp00142h
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Balato A, Schiattarella M, Lembo S, Mattii M, Prevete N, Balato N, et al. Interleukin-1 family members are enhanced in psoriasis and suppressed by vitamin D and retinoic acid. Arch Dermatol Res. (2013) 305:255–62. doi: 10.1007/s00403-013-1327-8
PubMed Abstract | CrossRef Full Text | Google Scholar
19., Borkowski AW, Kuo IH, Bernard JJ, Yoshida T, Williams MR, Hung NJ. Se requiere la activación del receptor 3 similar al peaje para la reparación normal de la barrera de la piel después del daño UV. J. Invest Dermatol. (2015) 135:569–78. doi: 10.1038 / jid.2014.354
PubMed Abstract | CrossRef Texto Completo | Google Scholar
20. Li N, Yamasaki K, Saito R, Fukushi-Takahashi S, Shimada-Omori R, Asano M, et al. Función alarmina del péptido antimicrobiano LL37 de cathelicidin a través de la inducción de IL-36γ en queratinocitos epidérmicos humanos. J Immunol., (2014) 193:5140–8. doi: 10.4049/jimmunol.1302574
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Patra V, Wolf P. Microbial elements as the initial triggers in the pathogenesis of polymorphic light eruption? Exp Dermatol. (2016) 25:999–1001. doi: 10.1111/exd.13162
PubMed Abstract | CrossRef Full Text | Google Scholar
22., Gläser R, Navid F, Schuller W, Jantschitsch C, Harder J, Schröder JM, et al. La radiación UV-B induce la expresión de péptidos antimicrobianos en queratinocitos Humanos in vitro e in vivo. J Allergy Clin Immunol. (2009) 123:1117–23. doi: 10.1016 / j. jaci.2009.01.043
PubMed Abstract | CrossRef Texto Completo | Google Scholar
23. Patra V, Mayer G, Gruber-Wackernagel A, Horn M, Lembo S, Wolf P., Perfil único de expresión de péptidos antimicrobianos en lesiones polimórficas de erupción ligera en comparación con piel sana, dermatitis atópica y psoriasis. Photodermatol Photoinmunol Photomed. (2018) 34:137–44. doi: 10.1111 / phpp.12355
PubMed Abstract | CrossRef Texto Completo | Google Scholar
25. Schweintzger NA, Gruber-Wackernagel a, Shirsath N, Quehenberger F, Obermayer-Pietsch B, Wolf P. Influence of the seasons on vitamin D levels and regulatory T cells in patients with polymorphic light eruption., Photochem Photobiol Sci. (2016) 15:440–6. doi: 10.1039/c5pp00398a
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Proby C, Baker C, Morton O, Hawk JLM. New broad spectrum sunscreen for polymorphic light eruption. Lancet (1993) 341:1347–8.
PubMed Abstract | Google Scholar
28. Allas S, Lui H, Moyal D, Bissonnette R., Comparación de la capacidad de 2 protectores solares para proteger contra la erupción de luz polimorfa inducida por una lámpara de halogenuros metálicos UV-A/UV-B. Arch Dermatol. (1999) 135:1421–2.
PubMed Abstract | Google Scholar
29. Ortel B, Wechdorn D, Tanew a, Honigsmann H. Effect of nicotinamide on the phototest reaction in polymorphous lighteruption. Br J Dermatol. (1988) 118:669–73.
PubMed Abstract | Google Scholar
30., Caccialanza M, Percivalle S, Piccinno R, Brambilla R. Photoprotective activity of oral Polypodiumleucotomos extract in 25 patients with idiopathic photodermatoses. Photodermatol Photoimmunol Photomed. (2007) 23:46–7. doi: 10.1111/j.1600-0781.2007.00274.x
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Tanew A, Radakovic S, Gonzalez S, Venturini M, Calzavara-Pinton P. Oral administration of a hydrophilic extract of Polypodiumleucotomos for the prevention of polymorphic light eruption., J Am Acad Dermatol. (2012) 66:58–62. doi: 10.1016/j.jaad.2010.09.773
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Van Praag MCG Boom, BW, Vermeer BJ. Diagnosis and treatment of polymorphous light eruption. Int J Dermatol. (1994) 33:233–9.
Google Scholar
34. Ling TC, Clayton TH, Crawley J, Exton LS, Goulden V, Ibbotson S, et al., British association of dermatologists and british photodermatology group guidelines for the safe and effective use of psoralen-ultraviolet a therapy 2015. Br J Dermatol. (2016) 174:24–55. doi: 10.1111 / bjd.14317
PubMed Abstract | CrossRef Texto Completo | Google Scholar
36. Man I, Dawe RS, Ferguson J. artificial hardening for polymorphic light eruption: practical points from ten years’ experience. Photodermatol Photoinmunol Photomed. (1999) 15:3–4.,
PubMed Abstract | Google Scholar
37. Mastalier U, Kerl H, Wolf P. Clinical laboratory, phototest and phototherapy findings in polymorphic light eruptions: a retrospective study of 133 patients. Eur J Dermatol. (1998) 8:554–9.
PubMed Abstract | Google Scholar
38. Krutmann J, Morita A. Mechanisms of ultraviolet (UV) B and UVA phototherapy. J Invest Dermatol Symp Proc. (1999) 4:70–2.,
PubMed Abstract | Google Scholar
39. Janssens AS, Pavel S, Out-Luiting JJ, Willemze R, de Gruijl FR. Normalized ultraviolet (UV) induction of Langerhans cell depletion and neutrophil infiltrates after artificial UVB hardening of patients with polymorphic light eruption. Br J Dermatol. (2005) 152:1268–74. doi: 10.1111/j.1365-2133.2005.06690.x
PubMed Abstract | CrossRef Full Text | Google Scholar
40., Wolf P, Gruber-Wackernagel a, Bambach I, Schmidbauer U, Mayer G, Absenger M, et al. El fotohardenamiento de los pacientes con erupción polimórfica disminuye la densidad epidérmica basal de células de Langerhans mientras aumenta el número de mastocitos en la dermis papilar. Exp Dermatol. (2014) 23:428–30. doi: 10.1111 / exd.12427
PubMed Abstract | CrossRef Texto Completo | Google Scholar
42. Schwarz a, Navid F, Sparwasser T, Clausen BE, Schwarz T., 1,25-dihydroxyvitamin D exerts similar immunosuppressive effects as UVR but is dispensable for local UVR-induced immunosuppression. J Invest Dermatol. (2012) 132, 2762–9. doi: 10.1038/jid.2012.238
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Norris PG, Hawk JL. Successful treatment of severe polymorphous light eruption with azathioprine. Arch Dermatol. (1989) 125:1377–9.
PubMed Abstract | Google Scholar