breve resumen del proceso Haber
el proceso Haber combina nitrógeno del aire con hidrógeno derivado principalmente del gas natural (metano) en amoníaco. La reacción es reversible y la producción de amoníaco es exotérmica.,
![]()
![]()
Un diagrama de flujo para el Proceso Haber se parece a esto:
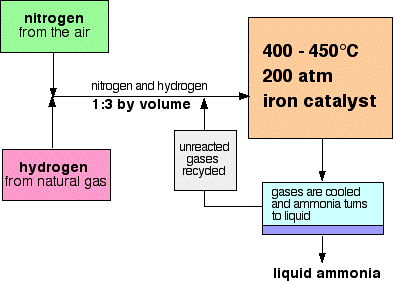
Algunas notas sobre las condiciones
El catalizador
El catalizador es en realidad un poco más complicado que el hierro puro. Tiene hidróxido de potasio añadido como promotor-una sustancia que aumenta su eficiencia.
La Presión
la presión varía de una planta de fabricación a otra, pero siempre es alta. No puedes equivocarte mucho en un examen citando 200 atmósferas.,
reciclaje
en cada paso de los gases a través del reactor, solo alrededor del 15% del nitrógeno y el hidrógeno se convierte en amoníaco. (Esta cifra también varía de planta en planta.) Mediante el reciclaje continuo del nitrógeno y el hidrógeno sin reaccionar, la conversión total es de aproximadamente el 98%.
explicando las condiciones
Las proporciones de nitrógeno e hidrógeno
la mezcla de nitrógeno e hidrógeno que entra en el reactor está en la relación de 1 volumen de nitrógeno a 3 volúmenes de hidrógeno.,
La Ley de Avogadro dice que volúmenes iguales de gases a la misma temperatura y presión contienen igual número de moléculas. Eso significa que los gases van al reactor en la proporción de 1 molécula de nitrógeno a 3 de hidrógeno.
que es la proporción demandada por la ecuación.
en algunas reacciones puede optar por utilizar un exceso de uno de los reactivos. Usted haría esto si es particularmente importante utilizar tanto como sea posible del otro reactivo – si, por ejemplo, era mucho más caro. Eso no se aplica en este caso.,
siempre hay un lado negativo al usar cualquier cosa que no sea las proporciones de la ecuación. Si tienes un exceso de un reactivo habrá moléculas que pasan a través del reactor que no pueden reaccionar porque no hay nada con lo que puedan reaccionar. Esto desperdicia el espacio del reactor, particularmente el espacio en la superficie del catalizador.
La temperatura
consideraciones de equilibrio
es necesario cambiar la posición del equilibrio en la medida de lo posible a la derecha con el fin de producir la máxima cantidad posible de amoníaco en la mezcla de equilibrio.,
La reacción directa (la producción de amoníaco) es exotérmica.
![]()
![]()
Según Le Chatelier del Principio, esta será favorecida si baja la temperatura. El sistema responderá moviendo la posición de equilibrio para contrarrestar esto, en otras palabras, produciendo más calor.
para obtener la mayor cantidad de amoníaco posible en la mezcla de equilibrio, necesita una temperatura lo más baja posible. Sin embargo, 400 – 450°C no es una temperatura baja!,
consideraciones de Velocidad
cuanto más baja sea la temperatura que use, más lenta será la reacción. Un fabricante está tratando de producir tanto amoníaco como sea posible por día. No tiene sentido tratar de lograr una mezcla de equilibrio que contenga una proporción muy alta de amoníaco si la reacción tarda varios años en alcanzar ese equilibrio.
es necesario que los gases alcancen el equilibrio en el muy corto tiempo que estarán en contacto con el catalizador en el reactor.,
el compromiso
400-450°C es una temperatura de compromiso que produce una proporción razonablemente alta de amoníaco en la mezcla de equilibrio (incluso si es solo 15%), pero en un tiempo muy corto.
La presión
Equilibrio consideraciones
![]()
![]()
Aviso de que hay 4 moléculas en el lado izquierdo de la ecuación, pero sólo el 2 a la derecha.,
según el principio de Le Chatelier, si aumenta la presión, el sistema responderá favoreciendo la reacción que produce menos moléculas. Eso hará que la presión caiga de nuevo.
para obtener la mayor cantidad de amoníaco posible en la mezcla de equilibrio, necesita una presión lo más alta posible. 200 atmósferas es una alta presión, pero no increíblemente alta.
consideraciones de Velocidad
aumentar la presión Acerca las moléculas., En este caso particular, aumentará sus posibilidades de golpear y pegarse a la superficie del catalizador donde pueden reaccionar. Cuanto mayor sea la presión, mejor en términos de la velocidad de reacción de un gas.
consideraciones económicas
Las presiones muy altas son muy costosas de producir por dos razones.
Usted tiene que construir tuberías extremadamente fuertes y recipientes de contención para soportar la presión muy alta. Eso aumenta sus costos de capital cuando se construye la planta.
Las altas presiones cuestan mucho producir y mantener., Eso significa que los costos de funcionamiento de su planta son muy altos.
el compromiso
200 atmósferas es una presión de compromiso elegida por motivos económicos. Si la presión utilizada es demasiado alta, el costo de generarla excede el precio que puede obtener por el amoníaco extra producido.
El catalizador
Equilibrio consideraciones
El catalizador no tiene ningún efecto sobre la posición de equilibrio. Agregar un catalizador no produce un mayor porcentaje de amoníaco en la mezcla de equilibrio. Su única función es acelerar la reacción.,
consideraciones de Velocidad
En ausencia de un catalizador, la reacción es tan lenta que prácticamente no ocurre ninguna reacción en cualquier momento sensible. El catalizador asegura que la reacción sea lo suficientemente rápida para que se establezca un equilibrio dinámico en el muy corto tiempo que los gases están realmente en el reactor.
separando el amoníaco
Cuando los gases salen del reactor están calientes y a una presión muy alta., El amoníaco se licúa fácilmente bajo presión siempre y cuando no esté demasiado caliente, por lo que la temperatura de la mezcla se reduce lo suficiente para que el amoníaco se convierta en líquido. El nitrógeno y el hidrógeno permanecen como gases incluso bajo estas altas presiones, y pueden ser reciclados.
preguntas para probar su comprensión
si este es el primer conjunto de preguntas que ha hecho, lea la página introductoria antes de comenzar. Usted tendrá que utilizar el botón Atrás en su navegador para volver aquí después.,
preguntas sobre el Proceso Haber
respuestas
¿Dónde te gustaría ir ahora?
al menú equilibrio . . .
al menú de Química Física . . .
Al Menú Principal . . .