hay cuatro leyes, conocidas como Leyes de Gas, que describen cómo se comportan los gases. Las cuatro leyes son la Ley de Boyle, la Ley de Charles, La Ley de Gay-Lussac y la Ley de Avogadro.
La Ley de Charles
Jacques Charles, un físico francés, descubrió en la década de 1780 que calentar un gas causará que se expanda en una cierta fracción. La siguiente imagen muestra cómo la adición de calor hace que las moléculas se muevan más rápido y golpeen los lados y la tapa con mayor fuerza, moviendo así la tapa hacia arriba a medida que el gas se expande.,
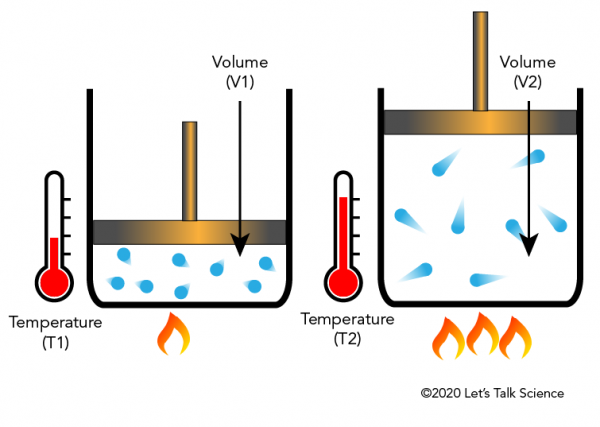
la Ley de Charles en la vida cotidiana
para hacer que un globo de aire caliente se eleve, se agrega calor al aire dentro del globo. La adición de calor hace que las moléculas se alejen más entre sí.

en lenguaje cotidiano, diríamos que el aire interior se expande. Cuando esto sucede, la densidad total (masa por unidad de volumen) del globo y el aire en su interior disminuye. Cuando la densidad del globo disminuye a ser menor que la densidad del aire exterior, el globo se eleva. Por el contrario, el volumen de un gas se reducirá si su temperatura disminuye.
a continuación se puede ver el nitrógeno líquido que se vierte sobre un globo verde. El nitrógeno líquido frío enfría el aire dentro del globo., Como resultado, las moléculas de aire se ralentizan haciendo que el volumen del globo disminuya.

durante las vacaciones, alguien que conoces puede haber utilizado un termómetro de pavo. Un termómetro de pavo se pega en el pavo mientras se cocina y luego aparece cuando la carne está lo suficientemente cocida. ¿Cómo funciona esta maravillosa pieza de tecnología? Tiene que ver con la Ley de Charles, por supuesto!, Dentro del termómetro de pavo hay una pequeña cantidad de aire. A medida que la temperatura aumenta dentro del pavo, el aire dentro del termómetro del pavo se expande. Una vez que alcanza un cierto volumen, la parte superior explota, diciéndole al chef que el pavo está bien cocinado.

La Ley de Gay-Lussac
Joseph Louis Gay-Lussac fue un químico y físico francés que descubrió en 1802 que si se mantiene el volumen de un gas constante (como en un contenedor cerrado), y se aplica calor, la presión del gas aumentará. Esto es debido a que los gases tienen más energía cinética, provocando a golpear las paredes del contenedor con más fuerza (lo que resulta en una mayor presión).
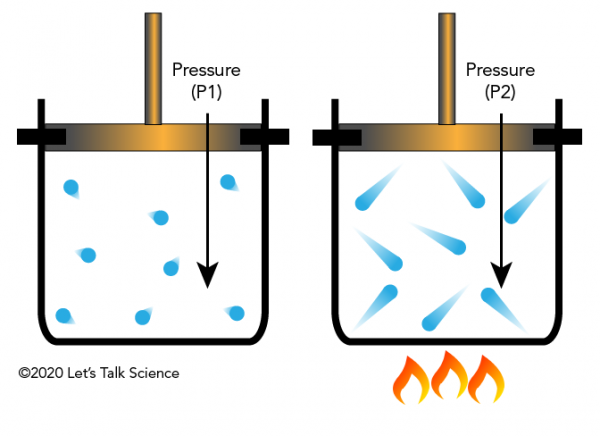
la Ley de Gay-Lussac en la vida cotidiana
dentro de una olla a presión, la comida que desea cocinar se encuentra en el agua. A medida que aumenta la temperatura del agua líquida, se produce vapor de agua (agua en estado gaseoso). Este vapor no puede escapar de la olla a presión, lo que significa que el volumen no cambia. La presión del vapor de agua sigue aumentando hasta que la temperatura del agua y el vapor de agua superan el punto normal de ebullición del agua (100 °C). A esta temperatura más alta los alimentos se pueden cocinar mucho más rápido., La carne dura también sale mucho más tierna después de ser cocinada en una olla a presión.

¿sabía que la presión de aire en el interior de los neumáticos cambia cuando se conduce el automóvil? Después de conducir, la presión del aire en los neumáticos de un automóvil aumenta. Esto se debe a que la fricción (una fuerza de contacto) entre los neumáticos y la carretera hace que el aire dentro de los neumáticos se caliente., El aire no puede expandirse porque los neumáticos son esencialmente un contenedor de volumen fijo, por lo que la presión aumenta, ¡Esta es la Ley de Gay – Lussac!