átomos y energía de la luz
el estudio de los átomos y sus características se superponen varias ciencias diferentes. Químicos, físicos y astrónomos deben entender la escala microscópica a la que funciona gran parte del Universo para ver el «panorama más grande».,
dentro del átomo
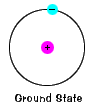 |
el estado fundamental de un electrón, el nivel de energía que normalmente ocupa, es el estado de energía más baja para ese electrón. |
| también Hay un máximo de energía que cada electrón canhave y aún parte de su átomo. Más allá de esa energía, el electronis ya no está unido al núcleo del átomo y se considera ionizado., | 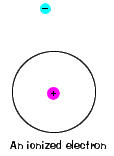 |
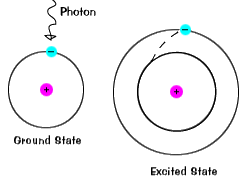 |
Cuando un electrón temporalmente ocupa un estado de energía mayor que itsground estado, está en un estado excitado.Un electrón se excita si se da extra de energía, como si itabsorbs un fotón, o los paquetes de luz, o choca con cerca de un átomo o partícula. |
la Energía de la Luz
Las ilustraciones de esta página son versiones simplificadas de átomos reales, por supuesto. Los átomos reales, incluso los relativamente simples como el hidrógeno,tienen muchos orbitales diferentes, por lo que hay muchas energías posibles con diferentes estados iniciales y finales., Cuando un átomo está en un estado excitado, el electrón puede caer hasta el estado fundamental de una sola vez, o detenerse en el camino en un nivel intermedio.
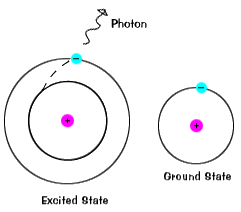 |
los electrones no permanecen en estados excitados por mucho tiempo – pronto vuelven a sus estados fundamentales, emitiendo un fotón con la misma energía que la que fue absorbida., |
identificando tipos individuales de átomos
Las transiciones entre los diversos orbitales son únicas para cada elemento porque los niveles de energía están determinados únicamente por los protones y neutrones en el núcleo. Sabemos que diferentes elementos tienen diferentes números de protones y neutrones en sus núcleos. Cuando los electrones de cierto átomo regresan a orbitales inferiores desde estados excitados, los fotones que emiten tienen energías que son características de ese tipo de átomo., Esto le da a cada elemento una huella digital única, lo que permite identificar los elementos presentes en un contenedor de gas, o incluso una estrella.
Podemos usar herramientas como la Tabla periódica de elementos para averiguar exactamente cómo tiene un átomo muchos protones, y por lo tanto electrones. En primer lugar, sabemos que para que un átomo tenga una carga neutra, debe tener el mismo número de protones y electrones. Si un átomo pierde o gana electrones, se desioniza, o se carga. La Tabla periódica nos dará el número atómico de un elemento. El número atómico nos dice cuántos protones tiene un átomo., Por ejemplo, el hidrógeno tiene un número atómico de uno – lo que significa que tiene un protón, y por lo tanto un electrón – y en realidad no tiene neutrones.
para el estudiante
basado en la descripción anterior del átomo, dibuje un modelo del átomo de hidrógeno. El modelo» estándar » de un átomo es conocido como el modelo Bohr.
diferentes formas del mismo elemento químico que difieren solo por el número de neutrones en su núcleo se llaman isótopos. La mayoría de los elementos tienen más de un isótopo natural., Se han producido muchos más isótopos en reactores nucleares y laboratorios científicos. Por lo general, los isótopos no son muy estables, y tienden a sufrir decaimiento radiactivo hasta que se forma algo más estable. Usted puede estar familiarizado con el elementuranio – tiene varios isótopos inestables, U-235 es uno de los más conocidos. El 235 significa que esta forma de uranio tiene 235 neutrones y protones combinados. Si buscamos el número atómico del uranio, y lo restamos de 235, podríamos calcular el número de neutrones que tiene el isótopo.,
Aquí hay otro ejemplo: el carbono generalmente ocurre en forma de c – 12 (carbono-12), es decir, 6 protones y 6 neutrones, aunque un isótopo es C-13, con 6protones y 7 neutrones.
para el estudiante
Use la Tabla periódica y los nombres de los elementos que se indican a continuación para averiguar cuántos protones, neutrones y electrones tienen.Dibuje un modelo de un átomo del siguiente elemento: silicio-28, magnesio-24, azufre-32, oxígeno-16 y helio-4.,
para el estudiante
usando el texto, defina los siguientes términos: niveles de energía, absorción, emisión, estado excitado, estado fundamental, ionización,átomo, elemento, masa atómica, número atómico, isótopo.
una nota opcional sobre la naturaleza mecánica cuántica de los átomosmientras que el átomo de Bohr descrito anteriormente es una buena manera de aprender sobre la estructura de los átomos, no es la forma más precisa de modelarlos., aunque cada orbital tiene una energía precisa, elelectrón ahora se visualiza como untado en una «nube de electrones» que rodea el núcleo. Es común hablar de la distancia media a la nube como el radio del electrón orbit.So solo recuerda, mantendremos las palabras «orbit» y «orbital», aunque ahora las usaremos para describir no un plano orbital plano, sino un área donde un electrón tiene una probabilidad de ser. Los electrones se mantienen cerca delenúcleo por la atracción eléctrica entre el núcleo y los electrones.,Mantenido allí de la misma manera que los nueve planetas permanecen cerca del sol en lugar de rugir la galaxia. A diferencia del sistema solar, donde todos los planetas están en el mismo plano, las órbitas de los electrones son más tridimensionales. Cada nivel de energía en un átomo tiene una forma diferente. Hay ecuaciones matemáticas que le dirán la probabilidad de la ubicación del electrón dentro de esa órbita. consideremos el átomo de hidrógeno, del que ya dibujamos un modelo de Bohr.,
el texto y las imágenes de esta sección fueron adaptados de la página de Dave Slaven sobre el átomo (ver referencias abajo). |

