catálisis heterogénea
en la catálisis heterogénea, el catalizador se encuentra en una fase diferente de los reactivos. Al menos uno de los reactivos interactúa con la superficie sólida en un proceso físico llamado adsorción de tal manera que un enlace químico en el reactivo se debilita y luego se rompe. Los venenos son sustancias que se unen irreversiblemente a los catalizadores, evitando que los reactivos se adsorban y, por lo tanto, reducen o destruyen la eficiencia del catalizador.,
un ejemplo de catálisis heterogénea es la interacción del gas hidrógeno con la superficie de un metal, como Ni, Pd o Pt. Como se muestra en la parte (a) en la figura \(\PageIndex{2}\), los enlaces hidrógeno–hidrógeno se rompen y producen átomos de hidrógeno adsorbidos individuales en la superficie del metal. Debido a que los átomos adsorbidos pueden moverse en la superficie, dos átomos de hidrógeno pueden chocar y formar una molécula de gas de hidrógeno que luego puede salir de la superficie en el proceso inverso, llamado desorción. Los átomos h adsorbidos en una superficie metálica son sustancialmente más reactivos que una molécula de hidrógeno., Debido a que el enlace H–H relativamente fuerte ( energía de disociación = 432 kJ / mol) ya se ha roto, la barrera de energía para la mayoría de las reacciones de H2 es sustancialmente más baja en la superficie del catalizador.
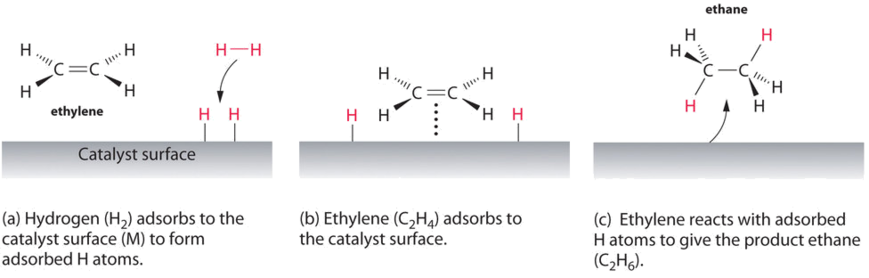
Figure \(\PageIndex{2}\) muestra un proceso llamado hidrogenación, en el que se agregan átomos de hidrógeno al doble enlace de un alqueno, como el etileno, para dar un producto que contiene enlaces simples C–C, En este caso etano., La hidrogenación se utiliza en la industria alimentaria para convertir los aceites vegetales, que consisten en largas cadenas de alquenos, en derivados sólidos de mayor valor comercial que contienen cadenas de alquilo. La hidrogenación de algunos de los dobles enlaces en los aceites vegetales poliinsaturados, por ejemplo, produce margarina, un producto con un punto de fusión, textura y otras propiedades físicas similares a las de la mantequilla.
varios ejemplos importantes de reacciones catalíticas heterogéneas industriales se encuentran en la tabla \(\PageIndex{1}\)., Aunque los mecanismos de estas reacciones son considerablemente más complejos que la simple reacción de hidrogenación descrita aquí, todas implican la adsorción de los reactivos en una superficie catalítica sólida, la reacción química de las especies adsorbidas (a veces a través de una serie de especies intermedias), y finalmente la desorción de los productos de la superficie.