Eine kurze Zusammenfassung des Haber-Verfahrens
Das Haber-Verfahren kombiniert Stickstoff aus der Luft mit Wasserstoff, der hauptsächlich aus Erdgas (Methan) zu Ammoniak gewonnen wird. Die Reaktion ist reversibel und die Produktion von Ammoniak ist exotherm.,
![]()
![]()
Ein Ablaufschema für den Haber-Prozess sieht folgendermaßen aus:
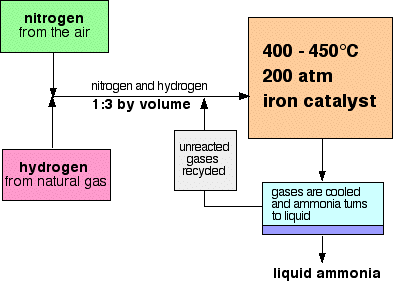
Einige Hinweise zu den Bedingungen
Der Katalysator
Der Katalysator ist eigentlich etwas komplizierter als reines Eisen. Es hat Kaliumhydroxid als Promotor hinzugefügt – eine Substanz, die seine Effizienz erhöht.
Der Druck
Der Druck variiert von Produktionsstätte zu Produktionsstätte, ist aber immer hoch. Bei einer Prüfung kann man nicht viel falsch machen.,
Recycling
Bei jedem Durchgang der Gase durch den Reaktor werden nur etwa 15% des Stickstoffs und Wasserstoffs in Ammoniak umgewandelt. (Diese Zahl variiert auch von Pflanze zu Pflanze.) Durch kontinuierliches Recycling des nicht umgesetzten Stickstoffs und Wasserstoffs beträgt die Gesamtumwandlung etwa 98%.
Erläuterung der Bedingungen
Die Anteile von Stickstoff und Wasserstoff
Die Mischung aus Stickstoff und Wasserstoff, die in den Reaktor gelangt, liegt im Verhältnis von 1 Volumen Stickstoff zu 3 Volumen Wasserstoff.,
Avogadros Gesetz besagt, dass gleiche Gasmengen bei gleicher Temperatur und demselben Druck gleiche Molekülzahlen enthalten. Das bedeutet, dass die Gase im Verhältnis von 1 Molekül Stickstoff zu 3 Wasserstoff in den Reaktor gelangen.
Das ist der Anteil, den die Gleichung verlangt.
In einigen Reaktionen können Sie einen Überschuss eines der Reaktanten verwenden. Sie würden dies tun, wenn es besonders wichtig ist, so viel wie möglich von dem anderen Reaktanten zu verbrauchen – wenn es zum Beispiel viel teurer wäre. Das gilt in diesem Fall nicht.,
Es gibt immer einen Nachteil, etwas anderes als die Gleichung Proportionen zu verwenden. Wenn Sie einen Überschuss an einem Reaktanten haben, passieren Moleküle den Reaktor, die unmöglich reagieren können, weil sie mit nichts reagieren können. Dies verschwendet Reaktorraum-insbesondere Platz auf der Oberfläche des Katalysators.
Die Temperatur
Gleichgewichtsüberlegungen
Sie müssen die Position des Gleichgewichts so weit wie möglich nach rechts verschieben, um die maximal mögliche Ammoniakmenge im Gleichgewichtsgemisch zu erzeugen.,
Die Vorwärtsreaktion (die Produktion von Ammoniak) ist exotherm.
![]()
![]()
Nach Le Chateliers Prinzip wird dies bevorzugt, wenn Sie die Temperatur senken. Das System reagiert, indem es die Gleichgewichtsposition bewegt, um dem entgegenzuwirken – mit anderen Worten, indem es mehr Wärme erzeugt.
Um möglichst viel Ammoniak in das Gleichgewichtgemisch zu bekommen, braucht man eine möglichst niedrige Temperatur. 400-450°C ist jedoch keine niedrige Temperatur!,
Rate Überlegungen
Je niedriger die Temperatur, die Sie verwenden, desto langsamer wird die Reaktion. Ein Hersteller versucht, so viel Ammoniak wie möglich pro Tag zu produzieren. Es macht keinen Sinn, zu versuchen, ein Gleichgewichtgemisch zu erreichen, das einen sehr hohen Ammoniakanteil enthält, wenn es mehrere Jahre dauert, bis die Reaktion dieses Gleichgewicht erreicht hat.
Sie benötigen die Gase, um innerhalb der sehr kurzen Zeit, in der sie mit dem Katalysator im Reaktor in Kontakt kommen, ein Gleichgewicht zu erreichen.,
Der Kompromiss
400-450°C ist eine Kompromisstemperatur, die einen einigermaßen hohen Ammoniakanteil im Gleichgewichtgemisch erzeugt (auch wenn sie nur 15% beträgt), jedoch in sehr kurzer Zeit.
Der Druck
Gleichgewichtsüberlegungen
![]()
![]()
Beachten Sie, dass sich auf der linken Seite der Gleichung 4 Moleküle befinden, auf der rechten Seite jedoch nur 2.,
Nach dem Prinzip von Le Chatelier reagiert das System, wenn man den Druck erhöht, indem es die Reaktion begünstigt, die weniger Moleküle produziert. Dadurch sinkt der Druck wieder.
Um möglichst viel Ammoniak in das Gleichgewichtgemisch zu bekommen, braucht man einen möglichst hohen Druck. 200 atmosphären ist ein hoher Druck, aber nicht erstaunlich hoch.
Ratenüberlegungen
Die Erhöhung des Drucks bringt die Moleküle näher zusammen., In diesem speziellen Fall erhöht es ihre Chancen, auf die Oberfläche des Katalysators zu treffen und dort zu haften, wo sie reagieren können. Je höher der Druck, desto besser in Bezug auf die Geschwindigkeit einer Gasreaktion.
Wirtschaftliche Überlegungen
Sehr hohe Drücke sind in zweifacher Hinsicht sehr teuer herzustellen.
Um dem sehr hohen Druck standzuhalten, müssen extrem starke Rohre und Containmentbehälter gebaut werden. Das erhöht Ihre Kapitalkosten, wenn die Anlage gebaut wird.
Hohe Drücke kosten viel zu produzieren und zu warten., Das bedeutet, dass die Betriebskosten Ihrer Anlage sehr hoch sind.
Der Kompromiss
200 Atmosphären ist ein aus wirtschaftlichen Gründen gewählter Kompromissdruck. Wenn der verwendete Druck zu hoch ist, übersteigen die Kosten für die Erzeugung den Preis, den Sie für das produzierte zusätzliche Ammoniak erhalten können.
Der Katalysator
Gleichgewichtsüberlegungen
Der Katalysator hat keinerlei Einfluss auf die Position des Gleichgewichts. Die Zugabe eines Katalysators erzeugt keinen größeren Ammoniakanteil im Gleichgewichtgemisch. Seine einzige Funktion ist es, die Reaktion zu beschleunigen.,
Ratenüberlegungen
In Abwesenheit eines Katalysators ist die Reaktion so langsam, dass praktisch keine Reaktion in einer vernünftigen Zeit stattfindet. Der Katalysator stellt sicher, dass die Reaktion schnell genug ist, um innerhalb der sehr kurzen Zeit, in der sich die Gase tatsächlich im Reaktor befinden, ein dynamisches Gleichgewicht herzustellen.
Trennt das Ammoniak
Wenn die Gase den Reaktor verlassen, sind sie heiß und haben einen sehr hohen Druck., Ammoniak wird unter Druck leicht verflüssigt, solange es nicht zu heiß ist, und so wird die Temperatur der Mischung so stark gesenkt, dass sich das Ammoniak in eine Flüssigkeit verwandelt. Stickstoff und Wasserstoff verbleiben auch unter diesen hohen Drücken als Gase und können recycelt werden.
Fragen um Ihr Verständnis zu testen
Wenn dies der erste Satz von Fragen, die Sie getan haben, lesen Sie bitte die Einführungsseite, bevor Sie beginnen. Sie müssen die SCHALTFLÄCHE ZURÜCK in Ihrem Browser verwenden, um danach hierher zurückzukehren.,
Fragen zum Haber-Prozess
Antworten
Wohin möchten Sie jetzt gehen?
Zum Menü Gleichgewicht . . .
Zum Menü Physikalische Chemie . . .
Zum Hauptmenü . . .