Atomer og Lys Energi
undersøgelsen af atomer og deres egenskaber overlapper flere differentsciences. Kemikere, fysikere og astronomer skal alle forståmikroskopisk skala, hvor meget af universet fungerer for at se det “større billede”.,
Inde i Atomet
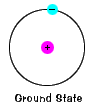 |
grundtilstanden af et elektron -, energi-niveau itnormally indtager, er den tilstand af laveste energi til at electron. |
| der er også en maksimal energi, som hver elektron kan have og stadig være en del af sit atom. Ud over denne energi er elektronerne ikke længere bundet til atomets kerne, og det anses for at være ioniseret., | 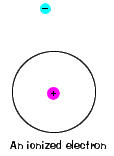 |
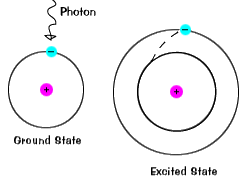 |
Når en elektron, der midlertidigt indtager en energitilstand, der er større end itsground tilstand, det er i en ophidset tilstand.En elektron kan blive ophidset, hvis det er givet ekstra energi, som hvis itabsorbs en foton, eller pakke af lys, eller kolliderer med en nærliggende atom eller partikel. |
Lys Energi
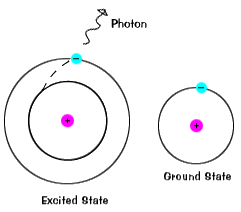 |
Elektroner ikke bo i exciterede tilstande for meget lang tid – de soonreturn at deres grund stater, som udsender en foton med den sameenergy som en, der var optaget., |
at Identificere de Enkelte Typer af Atomer
Overgange mellem de forskellige orbitals er unikke for hvert element, fordi theenergy niveauer er entydigt bestemt af protoner og neutroner i thenucleus. Vi ved, at forskellige elementer har forskellige antalprotoner og neutroner i deres kerner. Når elektronerne i et bestemt atom vender tilbage til lavere orbitaler fra ophidsede tilstande, har de fotoner, de udsender, energier, der er karakteristiske for den slags atom., Dette giver hverelement et unikt fingeraftryk, hvilket gør det muligt at identificere elementernetil stede i en beholder med gas eller endda en stjerne.
Vi kan bruge værktøjer som det periodiske system af elementer til at finde ud af præcishvor mange protoner, og dermed elektroner, et atom har. Først og fremmest ved vi, at for at et atom skal have en neutral ladning, skal den have det samme antalprotoner og elektroner. Hvis et atom mister eller får elektroner, bliver detioniseret eller ladet. Den periodiske tabel vil give os atomnummeret afet element. Atomnummeret fortæller os, hvor mange protoner et atomhar., For eksempel har hydrogen et atomnummer på en – hvilket betyder, at den har en proton og dermed en elektron – og har faktisk ingen neutroner.
For Studerende
Baseret på den tidligere beskrivelse af atomet, tegne amodel af brint atom. Den” standard ” model af et atom er kendtsom Bohr-modellen.
forskellige former for det samme kemiske element, der kun adskiller sig fra nummeretaf neutroner i deres kerne kaldes isotoper. De fleste elementer harmere end en naturligt forekommende isotop., Mange flere isotoper har væretproduceret i atomreaktorer og videnskabelige laboratorier. Isotoper normalt ikke meget stabil, og de har tendens til at gennemgå radioaktivt henfald indtilnoget, der er mere stabilt er dannet. Du kan være bekendt med elementuranium-det har flere ustabile isotoper, U-235 er en af de mestalmindeligt kendt. 235 betyder, at denne form for uran har 235 neutronerog protoner kombineret. Hvis vi kiggede op uranium atomnummer, og subtraheretat fra 235, kunne vi beregne antallet af neutroner, isotopen har.,
Her er et andet eksempel – kulstof forekommer normalt i form af C-12 (carbon-12), det vil sige 6 protoner og 6 neutroner, selvom en isotop er C-13, med 6protoner og 7 neutroner.
for den studerende
brug den periodiske tabel og navnene på elementerne nedenfor for at finde ud af, hvor mange protoner, neutroner og elektroner de har.Tegn en model af et atom af følgende element: silicium-28 -, magnesium-24, svovl-32, ilt-16, og helium-4.,
For Studerende
ved Hjælp af den tekst, du definere følgende begreber: energi-niveauer, absorption, emission, ophidset tilstand, jorden tilstand, ionisering,atom -, element, atommasse, atomnummer, isotop.
En Valgfri Bemærkning om den Kvantemekaniske Natur af AtomerMens Bohr atomet er beskrevet ovenfor, er et godt wayto lære om strukturen af atomer, det er ikke den mest præcise måde tomodel dem., selvom hver orbital har en præcis energi, er Electron nu forestillet som smurt ud i en “elektronsky”omkring kernen. Det er almindeligt at tale om den gennemsnitlige afstand til thecloud som radius af elektronens orbit.So bare husk, vi beholder ordene “kredsløb” og “orbital”, selvom vi nu bruger dem til at beskrive ikke et fladt orbitalplan, men aregion, hvor en elektron har en sandsynlighed for at være. elektroner holdes nærkerner ved den elektriske tiltrækning mellem kernen og elektronerne.,Holdes der på samme måde som de ni planeter forbliver nær Solen i stedet forrømmer galaksen. I modsætning til solsystemet, hvor alle planeternes orbitser på samme plan, er elektronbaner mere tredimensionale. Hverenerginiveau på et atom har en anden form. Der er matematiskeligninger, som vil fortælle dig sandsynligheden for elektronens placering inden for den bane. lad os overvejehydrogenatom, som vi allerede har tegnet en Bohr-model af.,
teksten og billederne i dette afsnit blev tilpasset fra Dave slavens side påatom (se referencer nedenfor). |

