Nucleophilic Substitution af Hydroxyl Gruppe
Den kemiske opførsel af alkyl halogenider kan bruges som reference i at opdage analog substitution og afskaffelse reaktioner af alkoholer. Den største forskel er selvfølgelig en ændring i den forlader anion fra halogenid til hydro .id. Da ilt er lidt mere elektronegative end klor (3,5 vs. 2.8 på Pauling skala), C-O bond forventes at være mere polære end en C-Cl bond., Endvidere indikerer et uafhængigt mål for carbonatomernes elektrofile egenskaber fra deres NMR-kemiske forskydninger (både 13C og alfa-protoner), at O .ygen-og chlorsubstituenter udøver en lignende elektronudvindende indflydelse, når de er bundet til sp3-hybridiserede carbonatomer. På trods af dette lovende baggrundsbevis gennemgår alkoholer ikke de samme SN2-reaktioner, der ofte observeres med alkylhalogenider. For eksempel har den hurtige SN2-reaktion af 1-bromobutan med natriumcyanid, vist nedenfor, ingen parallel, når 1-butanol behandles med natriumcyanid., Faktisk bruges ethylalkohol ofte som et opløsningsmiddel til alkylhalogenidsubstitutionsreaktioner som denne.
CH3CH2CH2CH2–Br + Na(+) KN(–)  CH3CH2CH2CH2–CN + Na(+) Br(–)
CH3CH2CH2CH2–CN + Na(+) Br(–)
CH3CH2CH2CH2–OH + Na(+) KN(–)  Ingen Reaktion
Ingen Reaktion
Den vigtigste faktor her, er stabiliteten af de forlader anion (bromid vs. hydroxid)., HBr er en meget stærkere syre end vand (med mere end 18 størrelsesordener), og denne forskel afspejles i reaktioner, der genererer deres respektive konjugatbaser. Den svagere base, bromid, er mere stabil, og dens frigivelse i en substitutions-eller eliminationsreaktion er meget gunstigere end hydro ionidion, en stærkere og mindre stabil base.
et klart skridt mod forbedring af alkoholernes reaktivitet i SN2 –reaktioner ville være at modificere-OH-funktionsgruppen på en måde, der forbedrer dens stabilitet som en efterladende anion., En sådan modifikation er at udføre substitutionsreaktionen i en stærk syre, der omdanner –OH til –OH2(+). Fordi hydroniumion (H3O (+)) er en meget stærkere syre end vand, er dens konjugatbase (H2O) en bedre efterladende gruppe end hydro .idion. Det eneste problem med denne strategi er, at mange nukleofiler, herunder cyanid, deaktiveres ved protonering i stærke syrer, hvilket effektivt fjerner det nukleofile co-reaktant, der kræves til substitutionen., De stærke syrer HCl, HBr og HI er ikke underlagt denne vanskelighed, fordi deres konjugatbaser er gode nukleofiler og er endnu svagere baser end alkoholer. De følgende ligninger illustrerer nogle substitutionsreaktioner af alkoholer, der kan blive påvirket af disse syrer. Som med alkylhalogenider fortsætter den nukleofile substitution af 1.-alkoholer med en SN2-mekanisme, hvorimod 3. – alkoholer reagerer med en SN1-mekanisme. Reaktioner af 2 alcohols-alkoholer kan forekomme af begge mekanismer og producerer ofte nogle omarrangerede produkter., Tallene i parentes ved siden af mineralsyreformlerne repræsenterer vægtprocenten af en koncentreret vandig opløsning, den form, hvori disse syrer normalt anvendes.
selvom disse reaktioner undertiden benævnes “syrekatalyseret”, er dette ikke strengt korrekt. I den samlede transformation omdannes en stærk h. – syre til vand, en meget svag syre, så i det mindste kræves en støkiometrisk mængde h. for en fuldstændig omdannelse af alkohol til alkylhalogenid., Nødvendigheden af at anvende ækvivalente mængder af meget stærke syrer i denne reaktion begrænser dens anvendelighed til simple alkoholer af den ovenfor viste type. Alkoholer med syrefølsomme grupper tolererer naturligvis ikke sådan behandling. Ikke desto mindre kan ideen om at ændre den funktionelle gruppe-OH for at forbedre dens stabilitet som en efterladende anion forfølges i andre retninger. Følgende diagram viser nogle ændringer, der har vist sig effektive. I hvert tilfælde omdannes hydro .ylgruppen til en ester af en stærk syre. De to første eksempler viser de tidligere beskrevne sulfonatestere., Det tredje og fjerde eksempel viser dannelsen af en phosphitester (respectively repræsenterer de resterende brom eller yderligere alkoholsubstituenter) og en chlorsulfit ester, henholdsvis. Alle disse efterladende grupper (farvet blå) har konjugatsyrer, der er meget stærkere end vand (med 13 til 16 kræfter på ti); således er den efterladende anion tilsvarende mere stabil end hydro .idionen. Mesylat-og tosylat-forbindelserne er særligt nyttige, fordi de kan anvendes i substitutionsreaktioner med en lang række nukleofiler., Mellemprodukterne produceret i reaktioner af alkoholer med fosfor tribromid og thionylchlorid (de to sidste eksempler) isoleres sjældent, og disse reaktioner fortsætter med at producere alkylbromid og chloridprodukter.
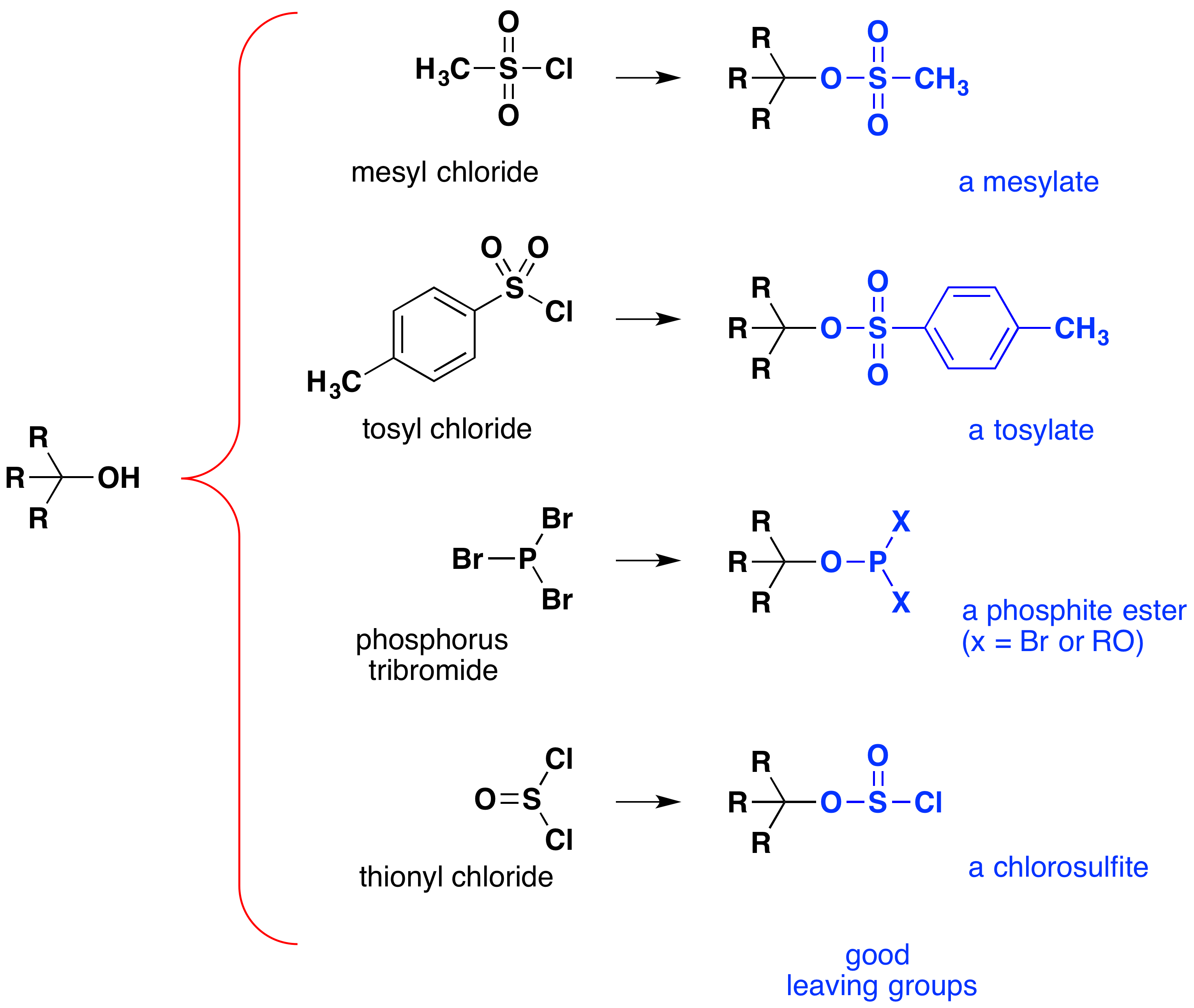
betydningen af sulfonate ester mellemprodukter i almindelighed nucleophilic substitution bivirkninger af alkoholer kan illustreres ved følgende konvertering af 1-butanol, at pentanenitrile (butyl cyanid), en reaktion, der ikke sker med den alkohol alene., Fosfor-og thionylhalogenider virker på den anden side kun for at omdanne alkoholer til de tilsvarende alkylhalogenider.,
| CH3CH2CH2CH2–OH + CH3SO2Cl | pyridine
|
CH3CH2CH2CH2–OSO2CH3 | Na(+) CN(–)
|
CH3CH2CH2CH2–CN + CH3SO2O(–) Na(+) |
Some examples of alcohol substitution reactions using this approach to activating the hydroxyl group are shown in the following diagram., De to første tilfælde tjener til at forstærke det faktum, at sulfonatesterderivater af alkoholer kan erstatte alkylhalogenider i en række SN2-reaktioner. De næste to tilfælde viser brugen af fosforstribromid til omdannelse af alkoholer til bromider. Dette reagens kan anvendes uden tilsat base (f.eks. pyridin), fordi fosforsyreproduktet er en svagere syre end HBr. Fosforstribromid bruges bedst med 1 alcohols-alkoholer, fordi 2.-alkoholer ofte giver omlejringsbiprodukter som følge af konkurrerende SN1-reaktioner., Bemærk, at ethero oxygenygenet i reaktion 4 ikke påvirkes af dette reagens, mens den alternative syntese ved anvendelse af koncentreret HBr spalter ethere. Phosphortrichlorid (PCl3) omdanner alkoholer til alkylchlorider på en lignende måde, men thionylchlorid foretrækkes normalt til denne transformation, fordi de uorganiske produkter er gasser (SO2 & HCl). Fosfortriiodid er ikke stabilt, men kan genereres in situ fra en blanding af rødt fosfor og jod og virker til at omdanne alkoholer til alkyliodider., Det sidste eksempel viser reaktionen af thionylchlorid med en chiral 2. – alkohol. Tilstedeværelsen af en organisk base, såsom pyridin, er vigtig, fordi den tilvejebringer en betydelig koncentration af chloridion, der kræves til den endelige SN2-reaktion af chlorosufitmidlet., I mangel af en base, chlorosufites nedbrydes ved varme til at give den forventede alkyl chlorid med fastholdelse af konfiguration
Tertiære alkoholer, er ikke almindeligt anvendt til substitution reaktioner af den type, der diskuteres her, fordi SN1 og E1 reaktion stier er dominerende, og er vanskelige at kontrollere.

betydningen af sulfonate estere som mellemprodukter i mange substitution reaktioner kan ikke overvurderes., Et stringent bevis på den konfigurationsinversion, der forekommer på substitutionsstedet i SN2-reaktioner, gør brug af sådanne reaktioner. Et eksempel på et sådant bevis vises nedenfor. Forkortelser for de mere almindeligt anvendte sulfonylderivater er angivet i nedenstående tabel.
| Sulfonyl-Gruppen | CH3SO2– | CH3C6H4SO2– | BrC6H4SO2– | CF3SO2– |
|---|---|---|---|---|
| Navn & Forkort., | Mesyl eller Ms | Tosyl eller Ts | Brosyl eller Bs | Trifyl eller Tf |
Inversion Bevis

For en mere fyldestgørende diskussion af hydroxyl substitution reaktioner og en beskrivelse af andre selektive metoder til denne transformation, Klik Her.
bidragsydere
- Williamilliam Reusch, Professor Emeritus (Michigan State U.,), Virtual Textbook of Organic Chemistry