et kort resum.af Haber-processen
Haber-processen kombinerer nitrogen fra luften med hydrogen, der hovedsageligt stammer fra naturgas (methan), til ammoniak. Reaktionen er reversibel, og produktionen af ammoniak er eksoterm.,
![]()
![]()
Et flowskema for til den Proces, der ligner denne:
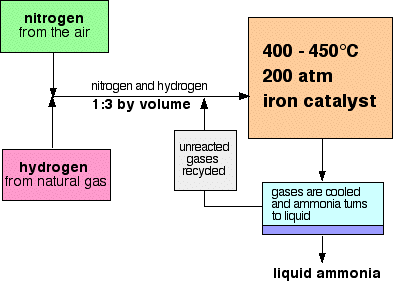
Nogle bemærkninger om betingelserne
katalysator
Den katalysator, er faktisk en smule mere kompliceret end rent jern. Det har kaliumhydro .id tilsat det som en promotor – et stof der øger dets effektivitet.
trykket
trykket varierer fra et produktionsanlæg til et andet, men er altid højt. Du kan ikke gå langt galt i en eksamen, der citerer 200 atmosfærer.,
genanvendelse
Ved hver passage af gasserne gennem reaktoren omdannes kun ca.15% af nitrogen og hydrogen til ammoniak. (Dette tal varierer også fra plante til plante.) Ved kontinuerlig genanvendelse af det ureagerede kvælstof og brint er den samlede omdannelse på ca. 98%.
forklarer betingelserne
andelene af nitrogen og hydrogen
blandingen af nitrogen og hydrogen, der går ind i reaktoren, er i forholdet mellem 1 volumen nitrogen og 3 volumener hydrogen.,Avogadros lov siger, at lige store mængder gasser ved samme temperatur og tryk indeholder lige mange molekyler. Det betyder, at gasserne går ind i reaktoren i forholdet mellem 1 molekyle nitrogen og 3 hydrogen.
det er den andel, der kræves af ligningen.
i nogle reaktioner kan du vælge at bruge et overskud af en af reaktanterne. Du ville gøre dette, hvis det er særlig vigtigt at bruge så meget som muligt af det andet reaktant – hvis det for eksempel var meget dyrere. Det gælder ikke i dette tilfælde.,
Der er altid en Do .n-side til at bruge noget andet end ligningen proportioner. Hvis du har et overskud af en reaktant, vil der være molekyler, der passerer gennem reaktoren, som umuligt kan reagere, fordi der ikke er noget for dem at reagere med. Dette affald reaktor plads-især plads på overfladen af katalysatoren.
temperaturen
Ligevægtsovervejelser
Du skal flytte ligevægtspositionen så langt som muligt til højre for at producere den maksimale mulige mængde ammoniak i ligevægtsblandingen.,
den fremadrettede reaktion (produktionen af ammoniak) er eksoterm.
![]()
![]()
i henhold til Le Chateliers princip vil dette blive foretrukket, hvis du sænker temperaturen. Systemet vil reagere ved at flytte ligevægtspositionen for at modvirke dette-med andre ord ved at producere mere varme.
for at få så meget ammoniak som muligt i ligevægtsblandingen, har du brug for så lav en temperatur som muligt. 400 – 450 C C er dog ikke en lav temperatur!,
Rate overvejelser
jo lavere temperatur du bruger, jo LANGSOMMERE bliver reaktionen. En producent forsøger at producere så meget ammoniak som muligt om dagen. Det giver ingen mening at forsøge at opnå en ligevægtsblanding, der indeholder en meget høj andel ammoniak, hvis det tager flere år for reaktionen at nå denne ligevægt.
du har brug for gassen for at nå ligevægt inden for meget kort tid, at de vil være i kontakt med katalysatoren i reaktoren.,
kompromiset
400 – 450.C er en kompromistemperatur, der producerer en rimelig høj andel ammoniak i ligevægtsblandingen (selvom den kun er 15%), men på meget kort tid.
tryk
Ligevægt overvejelser
![]()
![]()
Bemærk, at der er 4 molekyler på den venstre side af ligningen, men kun 2 til højre.,
ifølge Le Chateliers princip vil systemet, hvis du øger trykket, reagere ved at favorisere reaktionen, der producerer færre molekyler. Det vil få trykket til at falde igen.
for at få så meget ammoniak som muligt i ligevægtsblandingen, har du brug for så højt et tryk som muligt. 200 atmosfærer er et højt tryk, men ikke utroligt højt.
Rate overvejelser
forøgelse af trykket bringer molekylerne tættere sammen., I dette særlige tilfælde vil det øge deres chancer for at ramme og holde sig til overfladen af katalysatoren, hvor de kan reagere. Jo højere tryk jo bedre med hensyn til hastigheden af en gasreaktion.
økonomiske overvejelser
meget høje tryk er meget dyre at producere på to punkter.
du er nødt til at bygge ekstremt stærke rør og indeslutningsbeholdere for at modstå det meget høje tryk. Det øger dine kapitalomkostninger, når anlægget er bygget.
høje tryk koster meget at producere og vedligeholde., Det betyder, at driftsomkostningerne for dit anlæg er meget høje.
kompromiset
200 atmosfærer er et kompromistryk valgt af økonomiske grunde. Hvis det anvendte tryk er for højt, overstiger omkostningerne ved at generere det den pris, du kan få for den producerede ekstra ammoniak.
katalysatoren
Ligevægtsovervejelser
katalysatoren har ingen som helst indflydelse på ligevægtspositionen. Tilsætning af en katalysator producerer ikke nogen større procentdel af ammoniak i ligevægtsblandingen. Dens eneste funktion er at fremskynde reaktionen.,
Rate overvejelser
i fravær af en katalysator reaktionen er så langsom, at næsten ingen reaktion sker i nogen fornuftig tid. Katalysatoren sikrer, at reaktionen er hurtig nok til, at der kan etableres en dynamisk ligevægt inden for den meget korte tid, hvor gasserne faktisk er i reaktoren.
adskillelse af ammoniak
når gassen forlader reaktoren, er de varme og ved et meget højt tryk., Ammoniak er let flydende under tryk, så længe det ikke er for varmt, og så temperaturen af blandingen sænkes nok til ammoniak at vende sig til en væske. Nitrogen og hydrogen forbliver som gasser selv under disse høje tryk og kan genbruges.
spørgsmål for at teste din forståelse
Hvis dette er det første sæt spørgsmål, du har udført, skal du læse introduktionssiden, før du starter. Du skal bruge tilbage-knappen i din bro .ser for at komme tilbage her bagefter.,
spørgsmål om Haber-processen
svar
hvor vil du gerne hen nu?
til ligevægtsmenuen . . .
til menuen Fysisk Kemi . . .
til hovedmenuen . . .