Indledning
i Løbet af vinteren, nogle gange dermatologer modtage asymptomatiske patienter med ingen specifikke læsioner andet end, måske, nogle post-inflammatorisk misfarvning, men med et desperat behov for hjælp. De begynder at fortælle historien om en række papler eller vesikler, der vises på deres hud efter årets første intense soleksponering., Sammen med læsionerne begynder en frygtelig kløe og øges med sygdommens spredning efter den næste soleksponering, nogle gange forværret af en slags brændende fornemmelse. Ikke desto mindre er dette folk model Sun seekers og fortsætter med at nyde solskinnet hele sommeren og venter på, at papulerne gradvist falmer og forsvinder. De vigtigste spørgsmål er: hvordan kan jeg forhindre dette? Hvorfor får jeg dette problem siden ” 5 ” år nu, men jeg har aldrig haft det før?,
Vi beskæftiger os sandsynligvis med polymorf lysudbrud (PLE), og efter anmodninger fra vores patienter har medicinsk forskning hovedsageligt været fokuseret på forebyggelsesstrategier bliver i dag ganske tilfredsstillende. På den anden side forbliver det andet og bestemt mindre udforskede spørgsmål uklart, medmindre der er tilføjet flere stykker til dette temmelig komplicerede puslespil. Formålet med denne korte gennemgang er at genoptage de seneste fremskridt inden for mulige mekanismer og de mest anvendte protokoller til forebyggelse eller behandling.
Patofisiologi af polymorf Lysudbrud: Hvad er nyt?,
PLE er den hyppigste lysfølsomme lidelse, der er kendetegnet ved en periodisk tilbagevendende udbrud af ikke-ardannelse pruritisk erythematous papler, vesikler eller plaques (Figur 1), at udvikle sig inden for få timer af ultraviolet stråling (UVR) eksponering af patientens hud. Sygdommen er afhængig af genetisk modtagelighed, samt miljømæssige komponent, såsom type eksponering. PLE ser ud til at klynge sig i familier: det er blevet estimeret, at forekomsten af PLE var henholdsvis 21 og 18% hos enæggede og Di .ygotiske tvillinger (1)., Desuden en positiv familie historie af PLE i første-grads slægtninge var til stede i 12% af de ramte twin pairs forhold til 4% af upåvirket twin pairs (p < 0.0001). Den probandwise i overensstemmelse enæggede var bedre end i dizygotic twin pairs (0.72 vs. 0.30, henholdsvis), hvilket viser en stærk genetisk effekt (1). Mange gener af potentiel interesse i patogenesen af PLE er blevet undersøgt med generelt unre .arding resultater., Ved hjælp af segregationsanalyse er det blevet estimeret, at 72% af den britiske befolkning har en lav penetrans PLE modtagelighed allel (2).
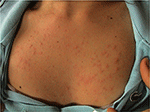
Figur 1. Klinisk billede af polymorf lysudbrud hos en ung kvinde.
Svigt af Apoptose: den Mulige Foto-Inducerede Neo-Antigener
I en nylig genom-dækkende udtryk analyse, er det kun 16 gener var differentielt udtrykte mellem PLE og sund kontrol efter UV-bestråling af hensyn til kontrol (3)., Af disse gener, 14 viste lavere ekspression hos PLE-patienter, hvorimod to resulterede over-udtrykt. Blandt de 14 gener med lavere udtryk i PLE er: supplement 1s-underenheden (C1s), scavenger receptor B1 (SCARB1) fibronectin (FN1), immunoglobulin overfamilie medlem 3 (IGSF3), caspase-1 (CASP1) og paraoxonase 2 (PON2), alle gener, der er forbundet med apoptotic celle clearance. Det er blevet antaget, at proteinmodifikation under apoptotisk celleclearance kan føre til potentiel auto-antigendannelse (4)., Derefter kan det reducerede ekspression hos PLE-patienter af gener, der er forbundet med denne proces, repræsentere en mulig auto-antigenkilde, såvel som en afgørende fase i indledningen af den autoimmune proces, der fremmer sygdommen (3). I overensstemmelse med disse fund, Kuhn et al. viste akkumulering af apoptotiske celler hos PLE-patienter bestrålet enten med 1, 5 Minimal Erythemdosis (MED) UVB eller 60-100 J/cm2 UVA1 sammenlignet med kontroller (5).,
Immunitet: Tolerance ‘ s Failure
Auto-antigener, der stammer fra ineffektiv afslutning af apoptotic celler, er sandsynligvis taget op af dendritiske celler (DCs) og præsenteret for naive T-celler (cytotoksiske og helper) derefter omdannet i auto-reaktive T-celler (6, 7). Dette delvis undladelse af apoptose bidrager, sammen med den utilstrækkelige immunosuppression efter UV-eksponering, at antigenet, indregning og præsentation, der fører til den kliniske manifestation typisk af PLE patienter (8)., Faktisk er svigt i normal UVR-induceret immunsuppression blevet bevist som den vigtigste immunologiske abnormitet i PLE, oprindeligt forklaret af varigheden af Langerhans-celler (LCs) i epidermis. Denne overaktivering af immunsystemet, der slipper ud til den funktionelle UV-inducerede tolerance, er sandsynligvis ansvarlig for den reducerede hudkræftprævalens hos PLE-patienter (9). På den anden side er den samme mekanisme skyldig i svigt i allergisk kontaktdermatitis (ACD) – undertrykkelse efter UVR-eksponering (10).,
inflammatorisk vej: overfølsomhedsreaktion af forsinket type
de immunologiske mekanismer involveret i PLE, med mediatorer fra det medfødte og adaptive immunsystem, er meget ens, enten fra det histologiske eller det biokemiske synspunkt, til ACD. I de tidlige halvfjerdserne indikerede Epstein først ple som en forsinket overfølsomhedsreaktion (DTHR) til udefineret UVR-induceret kutanantigen (11). For nylig, for at styrke dette koncept, er nogle af de inflammatoriske mediatorer involveret i ACD blevet demonstreret også i PLE., For eksempel er IL-1-familien (12, 13), en voksende gruppe af cytokiner, der spiller flere roller i immunregulering og betændelse (14), der også er involveret i ACD-patogenese (12, 15), også blevet undersøgt i PLE (16). IL-36α og IL-36,, de pro-inflammatoriske medlemmer af IL-1-familien blev forøget i PLE med hensyn til kontroller, som for ACD-prøver, men IL-36γ blev meget forbedret i PLE end i ACD (16). Virker gennem den fælles receptor sammensat af IL-36R og IL-1R/AcP (IL-1RL2), IL-36α, IL-36β og IL-36.aktiverer NF-kB og MAPKs, fremme inflammatoriske reaktioner., Forøgelsen af IL-36s i hud og perifert blod hos PLE-patienter indikerer aktiveringen af lokal og systemisk immunrespons, som findes i flere inflammatoriske hudsygdomme (15, 17, 18). Sandsynligvis, forbindelsen mellem IL-36s og UVR eksponering er repræsenteret ved paracrine pro-inflammatoriske signal om toll-like receptor (TLR)-3 aktivering, på grund af udgivelsen af RNA af nekrotisk keratinocytter (19). Faktisk kan svigt i apoptotisk clearance i PLE med overflod af cellulært affald være ansvarlig for en forstærkning af dette “alarmsignal.,”
desuden kunne IL-36s bidrage til at forstærke det medfødte immunsignal og den deraf følgende inflammatoriske kaskade, der fremmer antimikrobielle peptider (ampere) (20).
Inflammatoriske Vej: AMPs og Microbiome
Som i vid udstrækning er undersøgt i flere huden inflammatoriske processer, disse mediatorer, som er opkaldt som defensins (α-og β), cathelicidin (LL37), ribonuklease 7 (RNase7) og psoriasin (S100A7), i lyset af den ubalance, der er fremkaldt af UVR på keratinocytter og hud microbiome, har også været undersøgt i PLE (21, 22). Patra et al., har fundet, at ekspressionen af psoriasin, RNase7, HBD-2 og LL-37 blev forøget i PLE-læsionshud, hvorimod HBD-3 blev nedsat. I betragtning af hudoverfladen som en “multietnisk verden” uden at glemme keratinocyternes afgørende rolle, kan vi ikke udelukke, at ampere-frigivelse kunne bestemmes ved modifikation i mikrobiomkomponenter efter UV-interaktion (23). Faktisk kunne mikrobiom repræsentere kilden, direkte eller indirekte, af de endnu uopdagede UVR-inducerede antigener dannet hos PLE-patienter, hvilket fører til keratinocytskade., Som følge heraf kunne LL-37, også induceret af UVB, IFNy, TNF -,, IL-6, repræsentere en potentiel indirekte driver af PLE (23). Det kan danne aggregater med selv-nukleinsyrer, der er i stand til at aktivere PDC ‘ er: i psoriasis er det blevet anerkendt som den vigtigste autoantigen (24). Selvom der hos PLE-patienter er rapporteret om fuldstændigt fravær af PDC ‘ er (25), findes der et autoimmun miljø, og LL-37 kunne spille en central rolle, hvilket inducerer andre inflammatoriske veje. I figur S1 (supplerende materiale) visualiseres begreberne udtrykt ovenfor i en tegneserie.
terapi af polymorf Lysudbrud: Hvad er nyt?,
den første behandlingslinje for PLE inkluderer solundgåelse, solcreme og topiske kortikosteroider (26). For alle patienter er forebyggende behandling grundlæggende i solrigt vejr ved at undgå intens UVR-eksponering og brug af beskyttelsesbeklædning samt anvendelse af solcreme, især under årets første eksponering. Ny generation bredspektret solcreme med høj solbeskyttelsesfaktor for UVB (SPF) sammen med længere bølgelængde UVA-beskyttelse er rapporteret at give total eller delvis beskyttelse hos op til 90% af PLE-patienterne (27, 28)., Brug af orale antio .idanter og nikotinamid kan udgøre en yderligere gyldig forebyggende foranstaltning for disse patienter. De gavnlige virkninger af nicotinamid er blevet undersøgt i et ukontrolleret forsøg på 42 patienter, hvor 60% af dem har oplyst, fuldstændig afskaffelse af symptomer, når du tager 2-3 g nicotinamid dagligt, før solen eksponering (29). Desuden har et ekstrakt af den tropiske bregne Polypodiumleucotomos [PL) vist sig at udøve både potent antio .idant og immunmodulerende virkninger., Ved administration ved 480 mg / dagligt før soleksponering reducerede det signifikant hudreaktioner og subjektive symptomer (30, 31). Hvad angår topisk kortikosteroid, selvom der ikke er foretaget forsøg for at bestemme deres effektivitet i PLE, bruges de i vid udstrækning til at reducere kløe (26). Den anden linje af behandlinger for PLE inkluderer systemiske kortikosteroider og foto(kemo)terapi (26). I et randomiseret, dobbeltblind, placebokontrolleret forsøg (32) foreslog forfatterne brugen af 25 mg prednisolon dagligt i 4-5 dage ved udbrudets begyndelse., Selv om de potentielle langsigtede bivirkninger af gentagne kurser af prednisolon skal overvejes, kan det anbefales til patienter, der lider af lejlighedsvise angreb af PLE, i mangel af kontraindikationer. I mildere tilfælde af PLE kan et selvkonditioneringsprogram ved graduate eksponering for sollys i foråret være tilstrækkeligt (33). I mere alvorlige tilfælde kan medicinsk overvåget konditionerings – /desensibiliseringsbehandling være mere passende., Et kursus af psoralen og UVA-terapi (PUVA), smalbånd (NB)-UVB-eller bredbånd (BB)-UVB lysbehandling, normalt gives i det tidlige forår, kan være effektive såvel som profylaktisk behandling (26). Behandlingsprotokol består generelt af et kursus af fototerapi/fotokemoterapi over 5-6 uger. Start af doser afhænger af, minimal erythemal dosis (MED) eller minimum fototoksisk dosis (MPD), og er ofte 50-70% af disse målte tærskelværdier med gradvise stigninger., For at opretholde den fordel, der er opnået med desensibiliserende terapi, anbefales en regelmæssig soleksponering hele sommeren, ellers kan hærdningen gå tabt inden for 4-6 uger. Ved behandling af PLE bør NB-UVB foretrækkes frem for PUVA (styrke af anbefaling d; bevisniveau 4) på grund af den lavere risiko for fotocarcinogenese, ingen risiko for kvalme eller andre bivirkninger forbundet med indtagelse af moppe og ingen grund til at bruge øjenbeskyttelse efter behandling. PUVA bør dog overvejes, før andre systemiske behandlinger, hvis NB-UVB har svigtet eller tidligere har udløst udbruddet., I effekt, som er beskrevet nedenfor, er effekten har vist sig for flere lysbehandling regimer (BB-UVB, NB-UVB-og PUVA), og side-effekter, i udtrykket af udslæt provokation, rødme og kløe blev fundet at være mere fælles med UVB-end med PUVA (34). Som opsummeret resulterer effektiviteten af PUVA i litteraturen i en 65-100% fotobeskyttelseshastighed (34)., Flere sammenlignende undersøgelser er blevet udført, men kun randomized controlled trial mellem PUVA og NB-UVB-plus placebo tabletter, tre gange om ugen i 5 uger, ingen signifikant forskel i effekt opstod, i betragtning af forekomsten af PLE eller offentlig aktivitet begrænsning (35). I 10 års retrospektiv gennemgang, rapporteret af Man et al. (36), 170 patienter med moderat til svær PLE modtog PUVA og/eller UVB-fototerapi. I detaljer modtog 8 patienter PUVA, 128 NB-UVB, 5 BB-UVB og 29 patienter, der ikke reagerede tilfredsstillende på NB-UVB, fik PUVA det følgende år., Der blev foretaget selvvurderinger af sværhedsgraden, og hyppigheden af PLE-episoder blev rapporteret ved opfølgningsbesøgene i efteråret eller det følgende forår. God eller moderat forbedring blev rapporteret hos 88% af patienterne behandlet med PUVA og hos 89%, der fik UVB. Af de patienter, der blev behandlet med både PUVA og NB-UVB, foretrak flertallet PUVA. I en anden 14-års retrospektiv undersøgelse af 79 patienter behandlet med lysterapi (37), effektivitet, målt i løbet af den følgende sommer i løbetid photoprotection med færdigopbygget/delvis remission, var 65% for PUVA, 82% til BB-UVB og 83% for UVA alene., I dette tilfælde var behandlingen med PUVA forbeholdt mere alvorlige former.
de mekanismer, hvormed fototerapi inducerer fotobeskyttelse, forstås ikke fuldt ud.
i de sidste år er der imidlertid udført mange fremskridt. Ud over de velkendte virkninger på melaninisering og epidermal fortykning af fototerapi rapporteres en bred vifte af UV-induceret immunmodulerende og antiinflammatoriske egenskaber (38)., Både UVB-og UVA-modulere vedhæftning molekyle udtryk og fremkalde opløselige mediatorer, såsom en melanocyt-stimulerende hormon, IL-10 (som undertrykker produktionen af interferon-γ) og prostaglandin E2, at eksplicitere, anti-inflammatoriske handlinger, at forhindre aktivering af T-celler og fremmer apoptose af huden infiltrere T-celler (34). Det er endvidere blevet påvist, at profylaktisk UV photohardening i PLE patienter gendanner UV-induceret LC overgang fra hud til hud-dræning af lymfeknuder: en af de vigtigste cellulære begivenhed i UV-immunosuppression (39)., Tolerancen induceret af LC formidles ved frigivelse af immunsuppressiv cytokin, såsom IL-10, og ved interferens med modning og induktion af regulerende T-celler (Tregs) (40). Desuden er der for nylig rapporteret et interessant link blandt LC, Tregs og vitamin D3. Det er faktisk blevet påvist, at en kortvarig 1 uges topisk forbehandling med 1,25-dihydro .yvitamin d-analogen, calcipotriol, formindskede PLE-symptomer efter efterfølgende eksperimentel fotoprovokation (41)., Derudover viste 1,25-dihydro .yvitamin D i en murinundersøgelse sammenlignelige immunsuppressive virkninger som UV (42). En anden interessant krydstale er blevet fremhævet mellem LCs og mastceller. Ud over deres anerkendte rolle i atopi er dermale mastceller også ansvarlige for at beskytte huden mod UVB-induceret betændelse og fremme UV-immunsuppression (40). Humane undersøgelser har vist, at efter akut og kronisk UVR-eksponering øges antallet af dermale mastceller sammen med frigivelsen af IL-10., Samlet set antyder disse data en potentiel rolle for mastceller i PLE og i mekanismen for fotohærdning. I overensstemmelse hermed, Wolfolf et al. har rapporteret for første gang, at fotohærdning signifikant øger mastcelletætheden i papillær dermis hos PLE-patienter (40). Sammenfattende virker fotohærdning i PLE ved at genoprette den normale UV-immunundertrykkende vej, der involverer flere celletyper. Den tredje linje behandling for PLE omfatter brugen af systemiske immunsuppressive lægemidler, såsom A .athioprin og cyclosporin., Imidlertid rapporteres kun sporadiske tilfælde af patienter, der behandles med succes, i litteraturen (43, 44). Desuden, hydroxychloroquin, omega-3 fedtsyrer, og beta-caroten er blevet foreslået som behandlinger, men yderligere dobbelt-blind, randomiseret, kontrolleret forsøg til virkelig at vurdere deres kliniske effekt er påkrævet.
konklusioner
da den høje prævalens og stigende forekomst af PLE, der er forbundet med ubehag og livsstilsbegrænsninger, er fremtidige undersøgelser nødvendige for at finde nye terapeutiske og / eller forebyggende strategier., Valget af den passende PLE-behandling kræver et godt kendskab til sygdommens individuelle kliniske forløb sammen med muligheden for at udføre fototest. Nogle nye aspekter i den mulige aktivering og fremme af den inflammatoriske proces er blevet fremhævet.,
til den nuværende videnstilstand er det på trods af identifikationen af en afgørende cellulær regulering involveret i genoprettelsen af immuntolerancen vanskeligt at drage konkrete konklusioner om effektiviteten af forskellige potentielle behandlinger i PLE på grund af manglende tilstrækkelige undersøgelser og vanskeligheden med at vurdere resultatforanstaltninger. Den kliniske score til vurdering af sværhedsgraden (PLESI) (45) forbliver et instrument, der næppe anvendes og hovedsageligt begrænset til forskningsformål., Den dybere undersøgelse af de underliggende patogenetiske mekanismer i lidelsen vil muliggøre en mere målrettet behandlingsmetode.
Forfatterbidrag
SL projicerede manuskriptet, valgte materialet til papiret, skrev det oprindelige udkast og korrigerede følgende udkast til manuskriptet. AR var engageret i skrivning af manuskriptet, støtte nye ideer om indhold og stil.,
Erklæring om interessekonflikt
forfatterne erklærer, at forskningen blev udført i mangel af kommercielle eller økonomiske forhold, der kunne fortolkes som en potentiel interessekonflikt.
supplerende materiale
figur S1. Samspil mellem medfødt og adaptivt immunsystem i en sammenhæng med apoptosefejl i epidermis. (Grøn symbol) Psoriasin: rigelige udtryk i spinous og kornede lag af PLE hud. (Blåt symbol) RNase7: hovedsageligt udtrykt i keratinocytter af stratum granulosum og stratum corneum af PLE-læsioner., (Gul symbol) LL-37 blev dybt udtrykt i og omkring blodkar og kirtler i PLE. (Violet celle symbol) apoptotiske keratinocytter med ineffektiv clearance.,hic light eruption; ACD, Allergic contact dermatitis; DTHR, Delayed type hypersensitivity reaction; UVR, Ultraviolet radiation; C1s, Complement 1s subunit; SCARB1, Scavenger receptor B1; FN1, Fibronectin; IGSF3, Immunoglobulin superfamily member 3; CASP1, Caspase-1; PON2, Paraoxonase 2; MED, Minimal Erythema Dose; DCs, Dendritic cells; LCs, Langerhans cells; TLR, Toll like receptor; AMPs, Antimicrobial peptides; SPF, Sun protection factor; PUVA, Psoralen and UVA therapy; NB-UVB, Narrowband; BB-UVB, Broadband UVB; MPD, Minimum phototoxic dose; Tregs, Regulatory T cells; PL, Polypodiumleucotomos.,
2. McGregor JM, Grabczynska S, Vaughan R, Hawk JL, Lewis CM. Genetic modelling of abnormal photosensitivity in families with polymorphic light eruption and actinic prurigo. J Invest Dermatol. (2000) 115:471–6. doi: 10.1046/j.1523-1747.2000.00080.x
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Lembo S, Hawk JLM, Murphy GM, Kaneko K, Young AR, McGregor JM, et al., Aberrant gene expression with deficient apoptotic keratinocyte clearance may predispose to polymorphic light eruption. Br J Dermatol. (2017) 177:1450–3. doi: 10.1111/bjd.15200
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Savill J, Fadok V. Corpse clearance defines the meaning of cell death. Nature (2000) 407:784–8. doi: 10.,1038/35037722
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Kuhn A, Herrmann M, Kleber S, Beckmann-Welle M, Fehsel K, Martin-Villalba A, et al. Accumulation of apoptotic cells in the epidermis of patients with cutaneous lupus erythematosus after ultraviolet irradiation. Arthritis Rheum. (2006) 54:939–50. doi: 10.1002/art.21658
PubMed Abstract | CrossRef Full Text | Google Scholar
6., Savill J, Dransfield I, Gregory C, Haslett C. A blast from the past: clearance of apoptotic cells regulates immune responses. Nat RevImmunol. (2002) 2:965–75. doi: 10.1038/nri957
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Albert ML, Sauter B, Bhardwaj N. Dendritic cells acquire antigen from apoptotic cells and induce class I-restricted CTLs. Nature (1998) 392:86–9. doi: 10.,1038/32183
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Koulu LM, Laihia JK, Peltoniemi HH, Jansén CT. UV-induced tolerance to a contact allergen is impaired in polymorphic light eruption. J Invest Dermatol. (2010) 130:2578–82. doi: 10.1038/jid.2010.181
PubMed Abstract | CrossRef Full Text | Google Scholar
11. Epstein JH. Polymorphous light eruption. J Am Acad Dermatol. (1980) 3:329–43.,
PubMed Abstract | Google Scholar
12. Mattii M, Ayala F, Balato N, Filotico R, Lembo S, Schiattarella M, et al. The balance between pro- and anti-inflammatory cytokines is crucial in human allergic contact dermatitis pathogenesis: the role of IL-1 family members. Exp Dermatol. (2013) 22:813–9. doi: 10.1111/exd.12272
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Dinarello CA., Interleukin-1 i patogenesen og behandling af inflammatoriske sygdomme. Blod (2011) 117:3720-32. doi: 10.1182/blod-2010-07-273417
PubMed Abstract | CrossRef Fuld Tekst | Google Scholar
16. Lembo S, Caiazzo G, Balato N, Monfrecola G, Patra V, Wolf P, et al. Polymorf lysudbrud og IL-1 familiemedlemmer: nogen forskel med allergisk kontaktdermatitis? Photochem Photobiol Sci. (2017) 16:1471–9. doi: 10.,1039/c7pp00142h
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Balato A, Schiattarella M, Lembo S, Mattii M, Prevete N, Balato N, et al. Interleukin-1 family members are enhanced in psoriasis and suppressed by vitamin D and retinoic acid. Arch Dermatol Res. (2013) 305:255–62. doi: 10.1007/s00403-013-1327-8
PubMed Abstract | CrossRef Full Text | Google Scholar
19., Borkowski AW, Kuo IH, Bernard JJ, Yoshida T, Williams HR, Hang NJ. Toll-lignende receptor 3 Aktivering er nødvendig for normal hud barriere reparation efter UV-skader. J. Invest Dermatol. (2015) 135:569–78. doi: 10.1038 / jid.2014.354
PubMed Abstract | CrossRef Fuld Tekst | Google Scholar
20. Li N, Yamasaki K, Saito R, Fukushi-Takahashi S, Shimada-Omori R, Asano M, et al. Alarmin funktion af cathelicidin antimikrobielt peptid LL37 gennem IL-36γ induktion i humane epidermale keratinocytter. J Immunol., (2014) 193:5140–8. doi: 10.4049/jimmunol.1302574
PubMed Abstract | CrossRef Full Text | Google Scholar
21. Patra V, Wolf P. Microbial elements as the initial triggers in the pathogenesis of polymorphic light eruption? Exp Dermatol. (2016) 25:999–1001. doi: 10.1111/exd.13162
PubMed Abstract | CrossRef Full Text | Google Scholar
22., GL .ser R, Navid F, Schuller,, Jantschitsch C, Harder J, Schr ,der JM, et al. UV-B-stråling inducerer ekspressionen af antimikrobielle peptider i humane keratinocytter in vitro og in vivo. J Allergi Clin Immunol. (2009) 123:1117–23. doi: 10.1016/j.jaci.2009.01.043
PubMed Abstract | CrossRef Fuld Tekst | Google Scholar
23. Patra V, Mayer G, Gruber-Wackernagel En, Horn M, Lembo S, Wolf S., Unik profil af antimikrobiel peptidekspression i polymorfe lysudbrudslæsioner sammenlignet med sund hud, atopisk dermatitis og psoriasis. Photodermatol Photoimmunol Photomed. (2018) 34:137–44. doi: 10.1111 / phpp.12355
PubMed Abstract | CrossRef Fuld Tekst | Google Scholar
25. Schweintzger NA, Gruber-Wackernagel En, Shirsath N, Quehenberger F, Obermayer-Pietsch ‘ B, Wolf P. Indflydelse sæsoner på D-vitamin niveauer og regulatoriske T-celler hos patienter med polymorfe lys udbrud., Photochem Photobiol Sci. (2016) 15:440–6. doi: 10.1039/c5pp00398a
PubMed Abstract | CrossRef Full Text | Google Scholar
27. Proby C, Baker C, Morton O, Hawk JLM. New broad spectrum sunscreen for polymorphic light eruption. Lancet (1993) 341:1347–8.
PubMed Abstract | Google Scholar
28. Allas S, Lui H, Moyal D, Bissonnette R., Sammenligning af 2 solcreme evne til at beskytte mod polymorf lysudbrud induceret af en UV-A/UV-B metalhalogenidlampe. Arch Dermatol. (1999) 135:1421–2.
PubMed Abstract | Google Scholar
29. Ortel B ,echechdorn D, Tane.A, Honigsmann H. effekt af nicotinamid på fototestreaktionen ved polymorf lighteruption. Br J Dermatol. (1988) 118:669–73.
PubMed Abstract | Google Scholar
30., Caccialanza M, Percivalle S, Piccinno R, Brambilla R. Photoprotective activity of oral Polypodiumleucotomos extract in 25 patients with idiopathic photodermatoses. Photodermatol Photoimmunol Photomed. (2007) 23:46–7. doi: 10.1111/j.1600-0781.2007.00274.x
PubMed Abstract | CrossRef Full Text | Google Scholar
31. Tanew A, Radakovic S, Gonzalez S, Venturini M, Calzavara-Pinton P. Oral administration of a hydrophilic extract of Polypodiumleucotomos for the prevention of polymorphic light eruption., J Am Acad Dermatol. (2012) 66:58–62. doi: 10.1016/j.jaad.2010.09.773
PubMed Abstract | CrossRef Full Text | Google Scholar
33. Van Praag MCG Boom, BW, Vermeer BJ. Diagnosis and treatment of polymorphous light eruption. Int J Dermatol. (1994) 33:233–9.
Google Scholar
34. Ling TC, Clayton TH, Crawley J, Exton LS, Goulden V, Ibbotson S, et al., British association of dermatologists and british photodermatology group retningslinjer for sikker og effektiv anvendelse af psoralen-ultraviolet A terapi 2015. Br J Dermatol. (2016) 174:24–55. doi: 10.1111 / bjd.14317
PubMed Abstract | CrossRef Fuld Tekst | Google Scholar
36. Man I, Da .e RS, Ferguson J. kunstig hærdning til polymorf lysudbrud: praktiske punkter fra ti års erfaring. Photodermatol Photoimmunol Photomed. (1999) 15:3–4.,
PubMed Abstract | Google Scholar
37. Mastalier U, Kerl H, Wolf P. Clinical laboratory, phototest and phototherapy findings in polymorphic light eruptions: a retrospective study of 133 patients. Eur J Dermatol. (1998) 8:554–9.
PubMed Abstract | Google Scholar
38. Krutmann J, Morita A. Mechanisms of ultraviolet (UV) B and UVA phototherapy. J Invest Dermatol Symp Proc. (1999) 4:70–2.,
PubMed Abstract | Google Scholar
39. Janssens AS, Pavel S, Out-Luiting JJ, Willemze R, de Gruijl FR. Normalized ultraviolet (UV) induction of Langerhans cell depletion and neutrophil infiltrates after artificial UVB hardening of patients with polymorphic light eruption. Br J Dermatol. (2005) 152:1268–74. doi: 10.1111/j.1365-2133.2005.06690.x
PubMed Abstract | CrossRef Full Text | Google Scholar
40., Wolfolf P, Gruber-Wackackernagel A, Bambach I, Schmidbauer U, Mayer G, Absenger M, Et al. Fotohærdning af polymorfe lysudbrud patienter nedsætter baseline epidermal Langerhans celletæthed samtidig øge mastcelletal i papillær dermis. E Derp Dermatol. (2014) 23:428–30. doi: 10.1111/e 10d.12427
PubMed Abstract | CrossRef Fuld Tekst | Google Scholar
42. Schwarz En, Navid F, Sparwasser T, Clausen VÆRE, T. Schwarz, 1,25-dihydroxyvitamin D exerts similar immunosuppressive effects as UVR but is dispensable for local UVR-induced immunosuppression. J Invest Dermatol. (2012) 132, 2762–9. doi: 10.1038/jid.2012.238
PubMed Abstract | CrossRef Full Text | Google Scholar
43. Norris PG, Hawk JL. Successful treatment of severe polymorphous light eruption with azathioprine. Arch Dermatol. (1989) 125:1377–9.
PubMed Abstract | Google Scholar