læringsmål
- Ved de fysiske egenskaber af ioniske og molekylære stoffer.
den fysiske tilstand og egenskaber af en bestemt forbindelse afhænger i vid udstrækning af den type kemisk binding, den viser., Molekylære forbindelser, undertiden kaldet 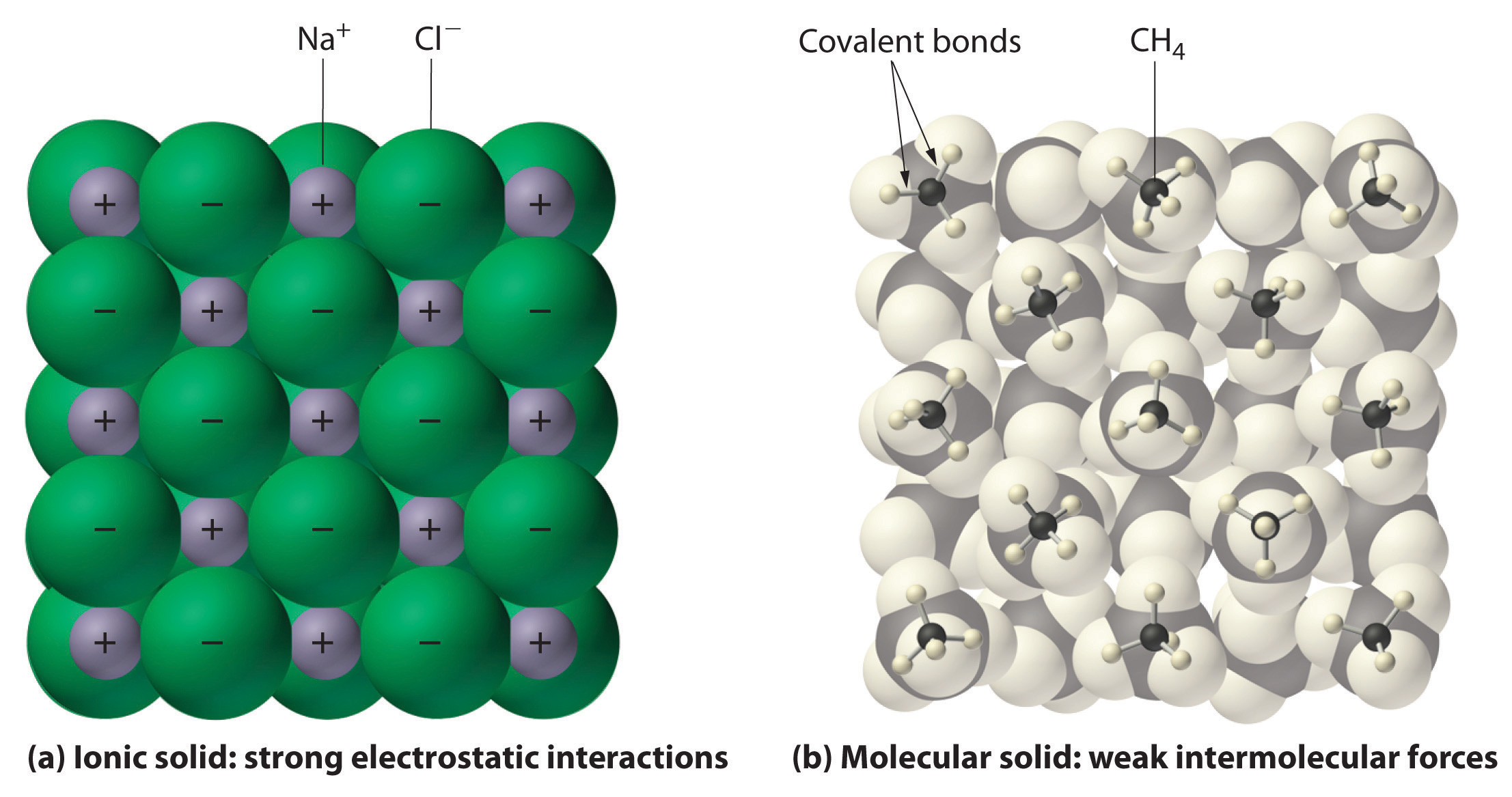 kovalente forbindelser, viser en lang række fysiske egenskaber på grund af de forskellige typer intermolekylære attraktioner, såsom forskellige former for polære interaktioner. Smeltepunktet og kogepunkterne for molekylære forbindelser er generelt ret lave sammenlignet med ioniske forbindelser. Dette skyldes, at den nødvendige energi til at forstyrre de intermolekylære kræfter mellem molekylerne er langt mindre end den energi, der kræves for at bryde den ioniske bindinger i en krystallinsk ioniske forbindelser (Figur \(\PageIndex{1}\)) ., Ioniske faste stoffer smelter typisk ved høje temperaturer og koger ved endnu højere temperaturer. For eksempel smelter natriumchlorid ved 801.C og koger ved 1413. C. (Til sammenligning smelter det molekylære sammensatte vand ved 0. C og koger ved 100. C.). Vandopløseligheden af molekylære forbindelser er variabel og afhænger primært af typen af involverede intermolekylære kræfter.
kovalente forbindelser, viser en lang række fysiske egenskaber på grund af de forskellige typer intermolekylære attraktioner, såsom forskellige former for polære interaktioner. Smeltepunktet og kogepunkterne for molekylære forbindelser er generelt ret lave sammenlignet med ioniske forbindelser. Dette skyldes, at den nødvendige energi til at forstyrre de intermolekylære kræfter mellem molekylerne er langt mindre end den energi, der kræves for at bryde den ioniske bindinger i en krystallinsk ioniske forbindelser (Figur \(\PageIndex{1}\)) ., Ioniske faste stoffer smelter typisk ved høje temperaturer og koger ved endnu højere temperaturer. For eksempel smelter natriumchlorid ved 801.C og koger ved 1413. C. (Til sammenligning smelter det molekylære sammensatte vand ved 0. C og koger ved 100. C.). Vandopløseligheden af molekylære forbindelser er variabel og afhænger primært af typen af involverede intermolekylære kræfter.
figur \(\Pageinde. {1}\) interaktioner i ioniske og kovalente faste stoffer.,
(a) de positivt og negativt ladede ioner i et ionisk fast stof, såsom
natriumchlorid (NaCl), holdes sammen af stærke elektrostatiske interaktioner.
(b) I denne repræsentation af pakning af metan (CH4) molekyler i faste metan,
en prototypisk molekylær solid, metan molekyler holdes sammen
i den solide kun af relativt svage intermolekylære kræfter, selv om
atomer i hver metan molekyle er holdt sammen af stærke kovalente bindinger.,da molekylære forbindelser er sammensat af neutrale molekyler, er deres elektriske ledningsevne generelt ret dårlig, hvad enten det er i fast eller flydende tilstand. I fast form er en ionforbindelse ikke elektrisk ledende, fordi dens ioner ikke er i stand til at strømme (“elektricitet” er strømmen af ladede partikler). Når smeltet, men det kan lede elektricitet, fordi dens ioner er i stand til at bevæge sig frit gennem væsken (Figur \(\PageIndex{2}\); Video \(\PageIndex{1}\)).,

Figur \(\PageIndex{2}\) natriumchlorid smelter på 801 °C og leder elektricitet, når det er smeltet. (credit: ændring af arbejde af Mark Blaser og Matt Evans)
Ledningsevne af Smeltet Salt
Video \(\PageIndex{1}\) Se denne video for at se en blanding af salte smelte og lede elektricitet.
tabellen nedenfor opsummerer nogle af forskellene mellem ioniske og molekylære forbindelser.,>
opløselighed i Vand
En type af molekylært stof opfører sig helt anderledes end den, der er beskrevet hidtil., Et kovalent netværksstof er en forbindelse, hvor alle atomerne er forbundet med hinanden ved kovalente bindinger. Diamant består udelukkende af carbonatomer, hver bundet til fire andre carbonatomer i en tetrahedral geometri. Smeltning af et kovalent netværksstof opnås ikke ved at overvinde de relativt svage intermolekylære kræfter. I stedet skal alle de kovalente bindinger brydes, en proces, der kræver ekstremt høje temperaturer. Diamant smelter faktisk slet ikke. I stedet fordamper den til en gas ved temperaturer over \(3500^\te .t{o} \te .t{C}\).,
resum.
- de fysiske egenskaber af et materiale påvirkes af de intermolekylære kræfter, der holder molekylerne sammen.
- ioniske forbindelser danner normalt hårde krystallinske faste stoffer med høje smeltepunkter. Kovalente molekylære forbindelser består derimod af diskrete molekyler, der holdes sammen af svage intermolekylære kræfter og kan være gasser, væsker eller faste stoffer ved stuetemperatur og tryk.
- ioniske forbindelser i smeltet form eller i opløsning kan lede elektricitet, mens molekylære forbindelser ikke gør det..,
Bidragydere
-
Marisa Alviar-Agnew (Sacramento City College)
-
Paul Blomster (University of North Carolina – Pembroke), Klaus Theopold (University of Delaware) og Richard Langley (Stephen F. Austin State University) med bidragende forfattere. Lærebog indhold produceret af opensta.College er licenseret under en Creative Commons Attribution License 4.0 licens. Do .nload gratis på http://cnx.org/contents/85abf193-2bd…[email protected]).,
-
CK-12 Fundament af Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, og Jean Dupon.