Lernziele
- Kennen Sie die physikalischen Eigenschaften ionischer und molekularer Substanzen.
Der physikalische Zustand und die Eigenschaften einer bestimmten Verbindung hängen zu einem großen Teil von der Art der chemischen Bindung ab, die angezeigt wird., Molekulare Verbindungen, manchmal als 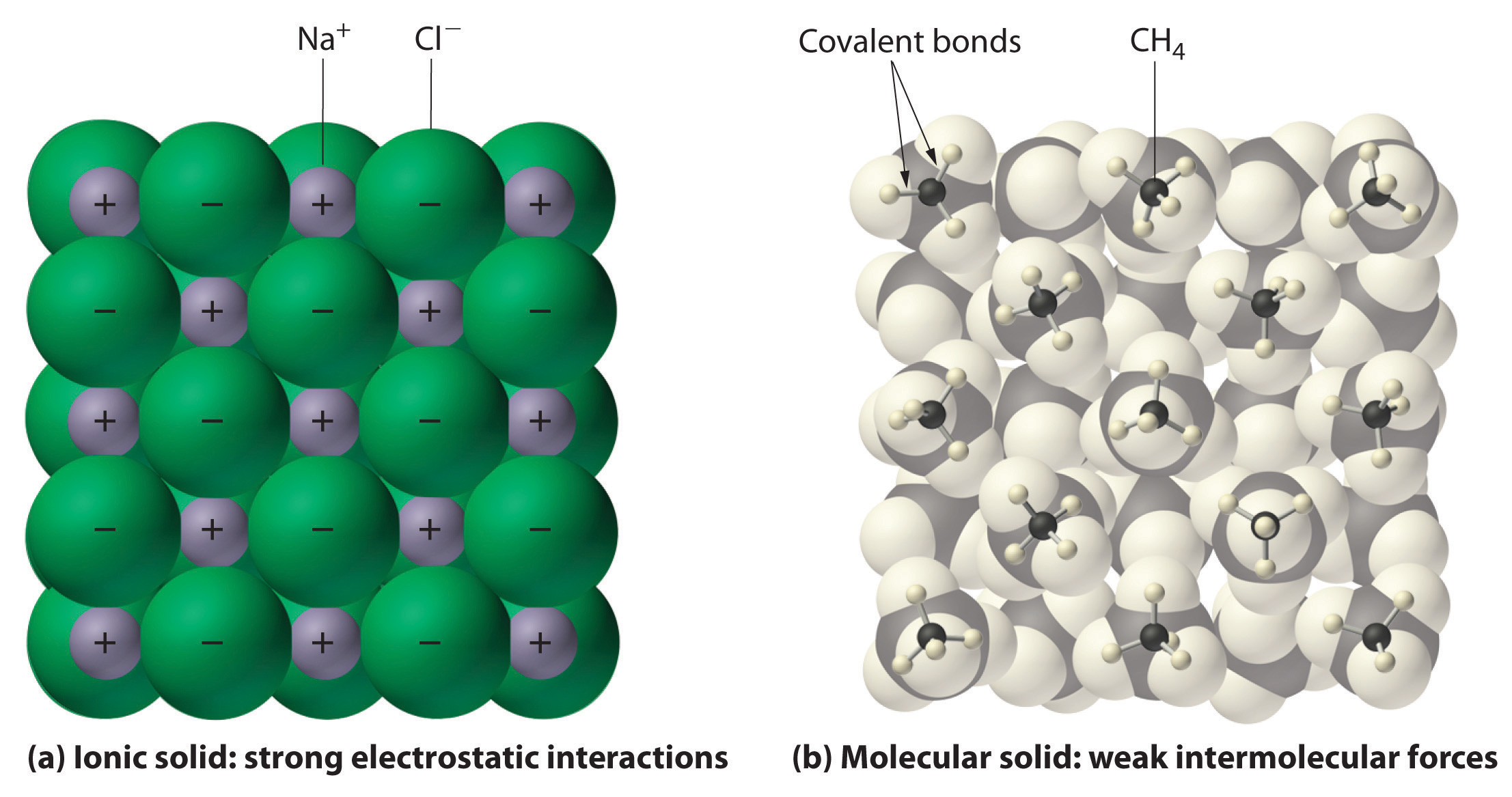 kovalente Verbindungen bezeichnet, weisen aufgrund der verschiedenen Arten intermolekularer Anziehungen, wie z. B. verschiedener Arten polarer Wechselwirkungen, eine breite Palette physikalischer Eigenschaften auf. Die Schmelz-und Siedepunkte molekularer Verbindungen sind im Allgemeinen ziemlich niedrig im Vergleich zu denen ionischer Verbindungen. Dies liegt daran, dass die Energie, die benötigt wird, um die intermolekularen Kräfte zwischen Molekülen zu unterbrechen, weit geringer ist als die Energie, die benötigt wird, um die Ionenbindungen in einer kristallinen ionischen Verbindung zu brechen (Abbildung \(\page{1}\)))., Ionische Feststoffe schmelzen typischerweise bei hohen Temperaturen und kochen bei noch höheren Temperaturen. Zum Beispiel schmilzt Natriumchlorid bei 801 °C und kocht bei 1413 °C. (Zum Vergleich schmilzt die molekulare Verbindung Wasser bei 0 °C und kocht bei 100 °C.). Die Wasserlöslichkeit molekularer Verbindungen ist variabel und hängt in erster Linie von der Art der intermolekularen Kräfte ab.
kovalente Verbindungen bezeichnet, weisen aufgrund der verschiedenen Arten intermolekularer Anziehungen, wie z. B. verschiedener Arten polarer Wechselwirkungen, eine breite Palette physikalischer Eigenschaften auf. Die Schmelz-und Siedepunkte molekularer Verbindungen sind im Allgemeinen ziemlich niedrig im Vergleich zu denen ionischer Verbindungen. Dies liegt daran, dass die Energie, die benötigt wird, um die intermolekularen Kräfte zwischen Molekülen zu unterbrechen, weit geringer ist als die Energie, die benötigt wird, um die Ionenbindungen in einer kristallinen ionischen Verbindung zu brechen (Abbildung \(\page{1}\)))., Ionische Feststoffe schmelzen typischerweise bei hohen Temperaturen und kochen bei noch höheren Temperaturen. Zum Beispiel schmilzt Natriumchlorid bei 801 °C und kocht bei 1413 °C. (Zum Vergleich schmilzt die molekulare Verbindung Wasser bei 0 °C und kocht bei 100 °C.). Die Wasserlöslichkeit molekularer Verbindungen ist variabel und hängt in erster Linie von der Art der intermolekularen Kräfte ab.
Abbildung \(\paeindex{1}\) Wechselwirkungen in ionischen und kovalenten Festkörpern.,
(a) Die positiv und negativ geladenen Ionen in einem ionischen Feststoff wie
Natriumchlorid (NaCl) werden durch starke elektrostatische Wechselwirkungen zusammengehalten.
(b) Bei dieser Darstellung der Verpackung von Methan (CH4) – Molekülen in festem Methan,
einem prototypischen molekularen Feststoff, werden die Methanmoleküle im Feststoff nur durch relativ schwache intermolekulare Kräfte zusammengehalten, obwohl
die Atome innerhalb jedes Methanmoleküls durch starke kovalente Bindungen zusammengehalten werden.,
Da molekulare Verbindungen aus neutralen Molekülen bestehen, ist ihre elektrische Leitfähigkeit im Allgemeinen ziemlich schlecht, sei es im festen oder flüssigen Zustand. In fester Form ist eine ionische Verbindung nicht elektrisch leitfähig, da ihre Ionen nicht fließen können („Elektrizität“ ist der Fluss geladener Teilchen). Wenn es jedoch geschmolzen ist, kann es Elektrizität leiten, da sich seine Ionen frei durch die Flüssigkeit bewegen können (Abbildung \(\pageIndex{2}\); Video \(\pageIndex{1}\)).,

Abbildung \(\pageIndex{2}\) Natriumchlorid schmilzt bei 801 °C und leitet Strom, wenn es geschmolzen ist. (credit: Änderung der Arbeit von Mark Blaser und Matt Evans)
Leitfähigkeit von geschmolzenem Salz
Video \(\pageIndex{1}\) Sehen Sie sich dieses Video an, um eine Mischung von Salzen zu sehen, die schmelzen und Elektrizität leiten.
Die folgende Tabelle fasst einige der Unterschiede zwischen ionischen und molekularen Verbindungen zusammen.,>
Wasserlöslichkeit
Eine Art molekularer Verbindung verhält sich ganz anders als bisher beschrieben., Ein kovalenter Netzwerkkörper ist eine Verbindung, in der alle Atome durch kovalente Bindungen miteinander verbunden sind. Diamant besteht vollständig aus Kohlenstoffatomen, die jeweils in einer tetraedrischen Geometrie an vier andere Kohlenstoffatome gebunden sind. Das Schmelzen eines kovalenten Netzwerkkörpers wird nicht durch Überwindung der relativ schwachen intermolekularen Kräfte erreicht. Vielmehr müssen alle kovalenten Bindungen gebrochen werden, ein Prozess, der extrem hohe Temperaturen erfordert. Diamant schmilzt tatsächlich überhaupt nicht. Stattdessen verdampft es zu einem Gas bei Temperaturen über \(C^\text{o} \text{C}\).,
Zusammenfassung
- Die physikalischen Eigenschaften eines Materials werden durch die intermolekularen Kräfte beeinflusst, die die Moleküle zusammenhalten.
- Ionische Verbindungen bilden üblicherweise harte kristalline Feststoffe mit hohen Schmelzpunkten. Kovalente molekulare Verbindungen hingegen bestehen aus diskreten Molekülen, die durch schwache intermolekulare Kräfte zusammengehalten werden, und können Gase, Flüssigkeiten oder Feststoffe bei Raumtemperatur und Druck sein.
- Ionische Verbindungen in geschmolzener Form oder in Lösung können Elektrizität leiten, molekulare Verbindungen nicht..,
Mitwirkende
-
Marisa Alviar-Agnew (Sacramento City College)
-
Paul Flowers (University of North Carolina – Pembroke), Klaus Theopold (University of Delaware) und Richard Langley (Stephen F. Austin State University) mit Co-Autoren. Lehrbuchinhalte, die vom OpenStax College produziert werden, sind unter einer Creative Commons Attribution License 4.0-Lizenz lizenziert. Kostenlos herunterladen unter http://cnx.org/contents/85abf193-2bd…[email protected]).,
-
CK-12 Foundation von Sharon Bewick, Richard Parsons, Therese Forsythe, Shonna Robinson, Jean Dupon.