Heterogene Katalyse
Bei der heterogenen Katalyse befindet sich der Katalysator in einer anderen Phase als die Reaktanten. Mindestens einer der Reaktanten interagiert mit der festen Oberfläche in einem physikalischen Prozess, der als Adsorption bezeichnet wird, so dass eine chemische Bindung im Reaktanten schwach wird und dann bricht. Gifte sind Substanzen, die irreversibel an Katalysatoren binden, um zu verhindern, dass Reaktanten adsorbieren und somit die Effizienz des Katalysators verringern oder zerstören.,
Ein Beispiel für heterogene Katalyse ist die Wechselwirkung von Wasserstoffgas mit der Oberfläche eines Metalls wie Ni, Pd oder Pt. Wie in Teil (a) in Abbildung \(\pageIndex{2}\) gezeigt, brechen die Wasserstoff–Wasserstoff-Bindungen und erzeugen einzelne adsorbierte Wasserstoffatome auf der Oberfläche des Metalls. Da sich die adsorbierten Atome auf der Oberfläche bewegen können, können zwei Wasserstoffatome kollidieren und ein Molekül Wasserstoffgas bilden, das dann die Oberfläche im umgekehrten Prozess verlassen kann, der als Desorption bezeichnet wird. Adsorbierte H-Atome auf einer Metalloberfläche sind wesentlich reaktiver als ein Wasserstoffmolekül., Da die relativ starke H-H-Bindung (Dissoziationsenergie = 432 kJ/mol) bereits gebrochen ist, ist die Energiebarriere für die meisten Reaktionen von H2 auf der Katalysatoroberfläche wesentlich geringer.
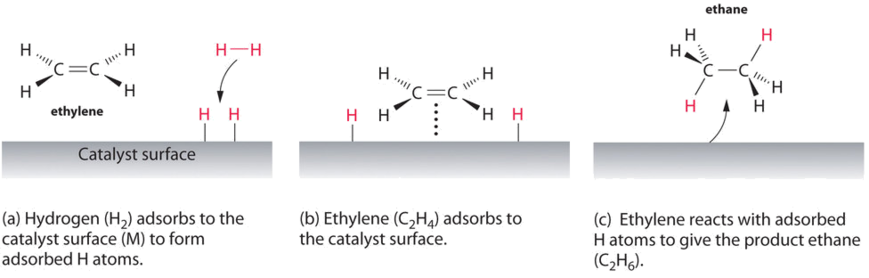
Abbildung \(\pageIndex{2}\) zeigt einen Prozess namens Hydrierung, bei dem Wasserstoffatome der Doppelbindung eines Alkens wie Ethylen zugesetzt werden, um ein Produkt zu erhalten, das C–C-Einzelbindungen enthält, in diesem Fall Ethan., Hydrierung wird in der Lebensmittelindustrie verwendet, um pflanzliche Öle, die aus langen Ketten von Alkenen bestehen, in kommerziell wertvollere feste Derivate umzuwandeln, die Alkylketten enthalten. Die Hydrierung einiger Doppelbindungen in mehrfach ungesättigten Pflanzenölen führt beispielsweise zu Margarine, einem Produkt mit Schmelzpunkt, Textur und anderen physikalischen Eigenschaften, die denen von Butter ähneln.
Einige wichtige Beispiele für industrielle heterogene katalytische Reaktionen sind in Tabelle \(\pageIndex{1}\) aufgeführt., Obwohl die Mechanismen dieser Reaktionen wesentlich komplexer sind als die hier beschriebene einfache Hydrierreaktion, beinhalten sie alle die Adsorption der Reaktanten auf eine feste katalytische Oberfläche, die chemische Reaktion der adsorbierten Spezies (manchmal über eine Reihe von Zwischenspezies) und schließlich die Desorption der Produkte von der Oberfläche.